题目内容
关于水的离子积常数,下列说法不正确的是( )
| A、蒸馏水中,c(H+)?c(OH-)=1×10-14 |
| B、纯水中,25℃时,c(H+)?c(OH-)=1×10-14 |
| C、25℃时,任何以水为溶剂的稀溶液中c(H+)?c(OH-)=1×10-14 |
| D、KW值随温度升高而增大 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:A、蒸馏水呈中性,离子积随温度变化;
B、纯水在常温下电离出氢离子和氢氧根离子浓度相同为10-7mol/L,结合离子积常数计算分析;
C、离子积常数在常温下c(H+)?c(OH-)=1×10-14 ,适用于任何稀的水溶液;
D、水的电离是吸热过程,离子积随温度变化.
B、纯水在常温下电离出氢离子和氢氧根离子浓度相同为10-7mol/L,结合离子积常数计算分析;
C、离子积常数在常温下c(H+)?c(OH-)=1×10-14 ,适用于任何稀的水溶液;
D、水的电离是吸热过程,离子积随温度变化.
解答:
解:A、蒸馏水呈中性,离子积随温度变化,温度不知离子积不能计算,故A错误;
B、纯水在常温下电离出氢离子和氢氧根离子浓度相同为10-7mol/L,结合离子积常数计算25℃时,c(H+)?c(OH-)=1×10-14,故B正确;
C、离子积常数在常温下c(H+)?c(OH-)=1×10-14 ,适用于任何稀的水溶液,25℃时,任何以水为溶剂的稀溶液中c(H+)?c(OH-)=1×10-14 ,故C正确;
D、水的电离是吸热过程,离子积随温度变化,温度升高,电离平衡正向进行,离子积增大,Kw增大,故D正确;
故选A.
B、纯水在常温下电离出氢离子和氢氧根离子浓度相同为10-7mol/L,结合离子积常数计算25℃时,c(H+)?c(OH-)=1×10-14,故B正确;
C、离子积常数在常温下c(H+)?c(OH-)=1×10-14 ,适用于任何稀的水溶液,25℃时,任何以水为溶剂的稀溶液中c(H+)?c(OH-)=1×10-14 ,故C正确;
D、水的电离是吸热过程,离子积随温度变化,温度升高,电离平衡正向进行,离子积增大,Kw增大,故D正确;
故选A.
点评:本题考查了水的电离平衡分析,离子积常数影响因素分析判断和计算,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
常温下,下列对醋酸稀溶液的叙述中,正确的是( )
A、将pH=a的醋酸稀释变为pH=a+1,醋酸的浓度则变为原来的
| ||
B、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| C、pH=a的醋酸与pH=a+1的醋酸分别中和等物质的量的NaOH溶液,二者所消耗体积比为1:10 | ||
| D、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
下列说法合理的是( )
| A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B、用碱式滴定管量取12.85mL高锰酸钾溶液 |
| C、用湿润的PH试纸测定某NaOH溶液的PH |
| D、过滤时可用玻璃棒搅拌加快过滤速度 |
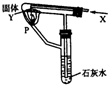 按如图的装置持续通入X气体并在支管P处点燃,实验时澄清石灰水变浑浊,则X、Y可能是( )
按如图的装置持续通入X气体并在支管P处点燃,实验时澄清石灰水变浑浊,则X、Y可能是( )| A、氢气和碳酸钠 |
| B、一氧化碳和碳酸钠 |
| C、一氧化碳和氧化铜 |
| D、氢气和氧化铁 |
下列有机物的命名中,不正确的是( )
| A、3,3-二甲基丁烷 |
| B、3-甲基-3-乙基戊烷 |
| C、4-甲基-3-乙基-2-己烯 |
| D、1-甲基-2-乙基-3-丙基苯 |
32He可以作为核聚变材料.下列有关32He的叙述正确的是( )
| A、32He 和31H互为同位素 |
| B、32He 原子核内中子数为2 |
| C、32He 原子核外电子数为2 |
| D、32He代表原子核内有2个质子和3个中子的氦原子 |
设阿伏加德罗常数为NA,下列说法中不正确的是( )
| A、15.6g Na2O2中含阴、阳离子数为0.6NA |
| B、标准状况下,11.2L CO2和O2的混合气体中含氧原子数为NA |
| C、8.7g MnO2和足量的浓盐酸反应,被氧化的Cl-为0.2NA |
| D、分子数为NA的CO、C2H4混合气体体积22.4L,其质量为28g |
下列说法中错误的是( )
| A、电解饱和食盐水,生成物总能量比反应物总能量高 |
| B、能自发进行的化学反应,不一定是△H<O,△S>0 |
| C、“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D、食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害 |
以“城市,让生活更美好”为主题的2010年上海世界博览会,向世人充分展示了“节能、环保、绿色低碳”给人类未来生活带来的经济、安全和便利.下列措施不能体现这一主题的是( )
| A、大力推广使用电动汽车,减少汽车尾气对环境的污染 |
| B、加大推广和普及硅太阳能发电,逐渐减少燃煤发电带来的危害 |
| C、不再生产和使用塑料制品,彻底解决“白色污染”问题 |
| D、利用竹炭装饰材料,吸收室内装修所产生的甲醛等有害气体 |