题目内容
元素铝是在生产、生活中应用广泛的金属元素。
(1)从矿石提取氧化铝:矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝。降温析出晶体时的反应方程式为: 。

(2)氧化铝是工业电解冶炼铝的重要原料,生产中加入冰晶石(Na3AlF6),其作用是 。
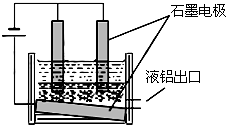
工业冶炼铝的装置示意图如右:
①阴极的反应式 ,
②在电解池工作过程中,需要不断补充阳极材料,原因是 。
(3)有资料介绍:溶液中铝元素以氢氧化物[用Al(OH)3表示]形式存在的pH范围是3.8~10。现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 。
(4)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。有关PAFC的说法正确的是 。(填选项)
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中都能稳定存在
31.(8分)
(1)NaAl(OH)4=Al(OH)3↓+NaOH (1分)。
(2)作(助)熔剂(降低氧化铝熔点,使其在1000℃左右即可熔化)(1分)。
①Al3++3e-=Al ;(1分)。
②电解阳极产生O2,在高温条件下,石墨阳极被不断的氧化为CO2。(2分)。
(3)Al3++3[Al(OH)4]-=4Al(OH)3↓(或Al3++3AlO2-+6H2O=4Al(OH)3↓) (1分)。
(4)①BC (2分)。
【解析】
试题分析:
(1)从题目后面可以推出再经净化和高温煅烧得到氧化铝。说明有Al(OH)3↓生成,因此反应可以写为NaAl(OH)4=Al(OH)3↓+NaOH 。
(2)由于氧化铝熔点非常高,要加热使其熔化需要很高的温度即消耗大量的能源,生产中加入冰晶石(Na3AlF6),作(助)熔剂(降低氧化铝熔点,使其在1000℃左右即可熔化)可以使其在较低温度下熔化,起始节约能源作用。
①阴极是阳离子得电子的反应,所以的反应式Al3++3e-=Al ;
②在电解池工作过程中,电解阳极产生O2,在高温条件下,石墨阳极被不断的氧化为CO2。
(3)弱酸的阴离子和弱碱的阳离子在水溶夜中时会发生双水解反应,可以写为Al3++3[Al(OH)4]-=4Al(OH)3↓(或Al3++3AlO2-+6H2O=4Al(OH)3↓)。
(4)由于PAFC的相对分子质量比较大,相同质量时其阳离子的量较少,离子水解时产生的氢离子浓度较小,因此比用相同量的氯化铝和氯化铁对水的pH改变小,另外该物质是一种碱式盐,相当于部分阳离子得到水解,故答案选择BC 。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊.若78克叠氮化钠完全分解,产生标准状况下氮气
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.计算溶液中氢氧化钠的物质的量浓度
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
己知通入二氧化碳112L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5.若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值.
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.部分测定结果如下表:
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
该铵盐的成分为
该铵盐中氮元素的质量分数为:
 [化学-化学与技术]
[化学-化学与技术]