题目内容
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中.
(1)工业上可以通过铁屑法生产KI,其工艺流程如图1所示:

①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为______.
②操作A包括______;用冰水洗涤的目的是______.
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产.
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是______,
②若制得1284kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水______ kg.
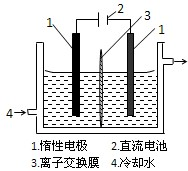
③KIO3还可通过如图2所示原理进行制备.电解时总反应的离子方程式为______.若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比______(选填“增大”、“减小”或“不变”).
解:(1)、①、根据铁元素与碘元素的质量比为21:127,铁、碘原子个数比为8:3,反应Ⅰ生成物化学式是 Fe3I8,反应Ⅱ的反应方程式是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
故答案是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
②、反应Ⅱ的滤液需要经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;由于碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,故用冰水洗涤;
故答案是:加热浓缩、冷却结晶、过滤; 洗涤除去表面可溶性杂质,同时减少KI的溶解损失.
(2)、①、由于碘酸钾的热稳定性较差,烹饪时,含KIO3的食盐常在出锅前加入;
故答案是:在较高温度下K1O3易分解;
②、1284kg KIO3固体的物质的量是6kmol,根据化合价升降相等,I2→IO3-化合价升高5价、H2O2→H2O化合价降低2价,关系式为:2KIO3~5H2O2
n(H2O2)= n(IO3-)=
n(IO3-)= ×6kmol=15kmol;消耗质量分数为30%的双氧水的质量为:
×6kmol=15kmol;消耗质量分数为30%的双氧水的质量为: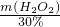 =
=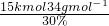 =1700kg;
=1700kg;
故答案是:1700kg;
③、图2中,阴极水中的氢离子得到电子生成氢气,阳极碘离子失去电子变成碘酸根离子,正反应为:I-+3H2O═IO3-+3H2↑; 根据正反应可知,溶液中PH不变化;
故答案是:I-+3H2O═IO3-+3H2↑; 不变.
分析:(1)、①、铁元素与碘元素的质量比为21:127,铁、碘原子个数比为8:3,反应Ⅰ生成了Fe3I8,反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁和二氧化碳的反应,Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
②、得到碘化钾,需要经过加热浓缩、冷却结晶、过滤,再降温、干燥得到碘化钾固体;冰水洗涤的目的是:洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)、①、碘酸钾加热容易分解,热稳定性差;
②、KIO3的摩尔质量是214g/mol,1284kg 固体的物质的量是6mol;根据化合价升降相等列出碘酸钾和双氧水的关系式:2KIO3~5H2O2;求出双氧水的物质的量,再计算出双氧水溶液的质量;
③、碘离子失去电子变成碘酸根离子、水中的氢离子得到电子生成氢气,反应离子方程式是:I-+3H2O═IO3-+3H2↑; 根据电解总反应方程式可知,电解结束后阴极区的pH与电解前没有变化.
点评:本题考查了制取及提纯碘化钾、碘酸钾的方法,题中内容较多,难度稍大.
故答案是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
②、反应Ⅱ的滤液需要经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;由于碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,故用冰水洗涤;
故答案是:加热浓缩、冷却结晶、过滤; 洗涤除去表面可溶性杂质,同时减少KI的溶解损失.
(2)、①、由于碘酸钾的热稳定性较差,烹饪时,含KIO3的食盐常在出锅前加入;
故答案是:在较高温度下K1O3易分解;
②、1284kg KIO3固体的物质的量是6kmol,根据化合价升降相等,I2→IO3-化合价升高5价、H2O2→H2O化合价降低2价,关系式为:2KIO3~5H2O2
n(H2O2)=
 n(IO3-)=
n(IO3-)= ×6kmol=15kmol;消耗质量分数为30%的双氧水的质量为:
×6kmol=15kmol;消耗质量分数为30%的双氧水的质量为: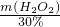 =
=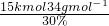 =1700kg;
=1700kg;故答案是:1700kg;
③、图2中,阴极水中的氢离子得到电子生成氢气,阳极碘离子失去电子变成碘酸根离子,正反应为:I-+3H2O═IO3-+3H2↑; 根据正反应可知,溶液中PH不变化;
故答案是:I-+3H2O═IO3-+3H2↑; 不变.
分析:(1)、①、铁元素与碘元素的质量比为21:127,铁、碘原子个数比为8:3,反应Ⅰ生成了Fe3I8,反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁和二氧化碳的反应,Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
②、得到碘化钾,需要经过加热浓缩、冷却结晶、过滤,再降温、干燥得到碘化钾固体;冰水洗涤的目的是:洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)、①、碘酸钾加热容易分解,热稳定性差;
②、KIO3的摩尔质量是214g/mol,1284kg 固体的物质的量是6mol;根据化合价升降相等列出碘酸钾和双氧水的关系式:2KIO3~5H2O2;求出双氧水的物质的量,再计算出双氧水溶液的质量;
③、碘离子失去电子变成碘酸根离子、水中的氢离子得到电子生成氢气,反应离子方程式是:I-+3H2O═IO3-+3H2↑; 根据电解总反应方程式可知,电解结束后阴极区的pH与电解前没有变化.
点评:本题考查了制取及提纯碘化钾、碘酸钾的方法,题中内容较多,难度稍大.

练习册系列答案
相关题目
 (2010?四川)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
(2010?四川)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
 碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )
碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.以碘为原料,通过电解可以制备碘酸钾.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示).以下有关该实验的说法错误的是( )
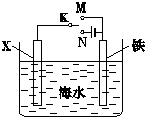 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于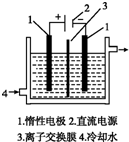 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与碘化物作用生成单质碘.
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与碘化物作用生成单质碘.