题目内容
【题目】某同学用0.1 mol/L 的盐酸滴定20.00 mL NaOH溶液,测定其浓度。下列操作正确的是
A. 需用NaOH溶液润洗锥形瓶
B. 用量筒量取20.00 mL NaOH溶液
C. 滴定前,使酸式滴定管尖嘴部分充满盐酸
D. 充分反应后,滴入酚酞溶液,观察是否到达滴定终点
【答案】C
【解析】
A.不能用NaOH溶液润洗锥形瓶,否则锥形瓶中氢氧化钠的量偏多,故A错误;
B.量筒的精确度为0.1mL,不能用量筒量取20.00 mL NaOH溶液,故B错误;
C.滴定前,需要排气泡,使酸式滴定管尖嘴部分充满盐酸,故C正确;
D.滴定前需要滴加指示剂,滴定时,注意观察是否到达滴定终点,故D错误;
答案选C。

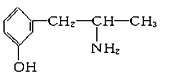
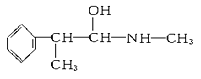
【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反应①中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:____________________该反应的平衡常数K3=_______________ 。 (反应①和反应②对应的平衡常数为K1和K2)
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如图所示表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=_____。

(4)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变