题目内容
【题目】在恒温恒容的密闭容器中通入lmol X和2molY,发生如下反应:X(g) + 2Y(g)![]() M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
A. v正(M)=2v逆(N)时,反应到达平衡状态
B. 到达平衡状态时,反应吸收akJ能量
C. 2s 末反应达到平衡时,加入催化剂,反应速率不会发生改变
D. 2s 末反应达到平衡时,Y的消耗量是X的生成量的2倍
【答案】D
【解析】
A.不同物质的正逆反应速率之比等于化学计量数之比时,达到平衡状态,v正(M)=2v逆(N)时,说明正反应速率>逆反应速率,反应不是平衡状态,故A错误;
B.物质的量与热量成正比,该反应为可逆反应,参加反应的X小于1mol,则平衡时放出热量小于akJ,故B错误;
C. 加入催化剂,反应速率会发生改变,故C错误;
D. 根据方程式,2s 末反应达到平衡时,正反应速率=逆反应速率,Y的消耗量是X的生成量的2倍,故D正确;
答案选D。

练习册系列答案
相关题目
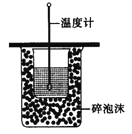
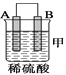
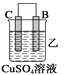
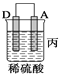
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________mol
(3)装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________。