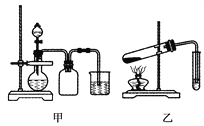
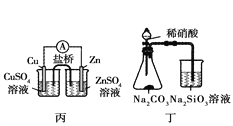
题目内容
【题目】铁、铜混合粉末20.0g加入到100mL 5.0 mol·L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。求:
(1)反应后溶液中FeCl2的物质的量浓度_____________ mol·L-1
(2)原固体混合物中铜的质量分数是_____________
【答案】 6.5 58%
【解析】试题分析:铁的金属性强于铜,氯化铁首先氧化铁,结合氯化铁的物质的量以及固体的质量分析判断铜部分参与反应,进而计算。
解析:(1)固体剩余,则氯化铁全部反应。如果铜不参与反应,根据氯离子守恒可知氯化亚铁的物质的量是0.1L×5mol/L×3/2=0.75mol,因此消耗铁是0.75mol-0.5mol=0.25mol,质量是14g,而固体减少质量是14.8g,所以铜部分反应。设混合溶液中氯化亚铁和氯化铜分别是xmol、ymol,则x+y=0.75、(x-0.5)×56+64y=20-5.2,解得x=0.65、y=0.1,因此反应后溶液中FeCl2的物质的量浓度0.65mol÷0.1L=6.5 mol·L-1。
(2)原固体混合物中铜的质量分数是![]() ×100%=58%。
×100%=58%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
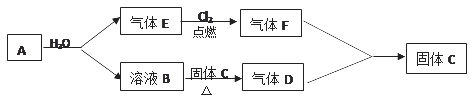
小学生10分钟应用题系列答案【题目】如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 
(1)已知该产业链中某反应的平衡表达式为:K= ![]() ,它所对应反应的化学方程式为;
,它所对应反应的化学方程式为;
(2)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: ①CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(i)催化反应室中总反应的热化学方程式为 , 830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”).
(ii)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=mol/L.
(iii)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
①此时刻,v正v逆(填“大于”、“小于”或“等于”).
②平衡时二甲醚的物质的量浓度是 .