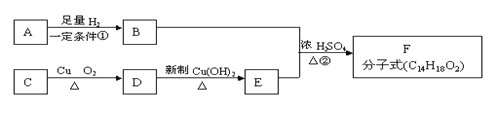
题目内容
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图。下列说法一定不正确的是

A. Z原子比X原子的最外层电子数多2个
B. 原子半径:W>X>Z>Y
C. 最高价氧化物对应的水化物的碱性:X>W
D. Y单质与氢气反应条件比Z单质更苛刻
【答案】B
【解析】A根据短周期元素X、Y、Z、W在周期表中的位置关系知. Z原子比X原子的最外层电子数多2个,是正确的,故A对;B. W和X同一周期,原子半径W<X;Z 和Y 同一周期,原子半径Z<Y ,故B错;C.因为 X W在同一周期原子序数逐渐增大,所以金属性X .>W,其最高价氧化物对应的水化物的碱性也是X .>W。故C正确;D Y Z在同一周期原子序数逐渐增大,所以非金属性Z>Y, Y单质与氢气反应条件比Z单质更苛刻是对的。故D正确。答案B。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】关于下列实验的说法不正确的是:
操作 | 现象 |
| ①铜片溶解,溶液变蓝,起始产生红棕色气体,气体颜色逐渐变淡,直至无色,在管口处变为淡棕色 ②铜片继续溶解,产生无色气体,在管口处变为淡棕色 |
A. 实验中产生红棕色气体,说明浓HNO3具有氧化性
B. 在整个实验过程中,发生的反应多于2个
C. ②中产生无色气体,说明盐酸有氧化性
D. 若将铜片换成铁片,则①中没有明显实验现象。
【题目】钡盐生产过程中排出大量钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:
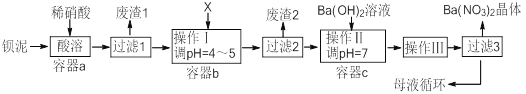
已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大,在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理 。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为 。
(3)结合本厂生产实际,X试剂应选下列中的 。
A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为 。
(5)操作III为 。
(6)过滤III后的母液应循环到容器 中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。