题目内容
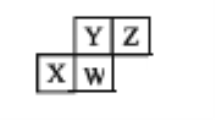
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2] 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. H+进过质子交换膜由右向左移动
【答案】B
【解析】甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,A.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故A错误;B CO(NH2)2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+,所以B选项是正确的;C.当N电极消耗0.25mol氧气时,则转移0.25![]() =1mol电子,所以铁电极增重
=1mol电子,所以铁电极增重![]() ,故C错误;D.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,即由左向右移动,故D错误.所以B选项是正确的.
,故C错误;D.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,即由左向右移动,故D错误.所以B选项是正确的.

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)![]() CH3OCH3(g+3H2(g) △H
CH3OCH3(g+3H2(g) △H
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7kJ.mol-l
CH3OH(g) △H1=-90.7kJ.mol-l
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ.mol-l
CO2(g)+H2(g) △H2=-41.2kJ.mol-l
(1)△H_____ kJ.mol-l
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P前/P后) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则达到平衡时CO的转化率为_________。
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示。从图中可得出三条主要规律:
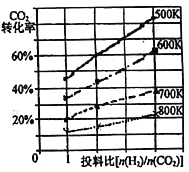
①增大投料比,CO2的转化率增大;②_____________;③_______________。
(4)反应③的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。
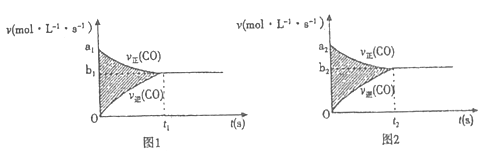
下列说法正确的是________。
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦ t1<t2 ⑧两图中阴影部分面积相等⑨右图阴影部分面积更大 ⑩左图阴影部分面积更大
A. ①③⑦⑧ B. ①③⑤⑧ C. ②④⑦⑨ D. ①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:____________。与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是______________。