题目内容
【题目】下列过程中,最终的白色沉淀不一定是BaSO4的是( )
A.Ba(NO3)2溶液 ![]() 白色沉淀
白色沉淀
B.无色溶液 ![]()
![]() 白色沉淀
白色沉淀
C.Ba(NO3)2溶液 ![]() 无现象
无现象 ![]() 白色沉淀
白色沉淀
D.Fe(NO3)2溶液 ![]()
![]()
![]() 白色沉淀
白色沉淀
【答案】B
【解析】解:A.二氧化硫具有还原性,酸性条件下与硝酸钡发生氧化还原反应生成硫酸钡白色沉淀,故A不选; B.无色溶液可能含银离子或亚硫酸根离子,且二者不能同时存在,则无色溶液 ![]()
![]() 白色沉淀,白色沉淀可能为AgCl,故B选;
白色沉淀,白色沉淀可能为AgCl,故B选;
C.先加盐酸无现象,排除银离子干扰,再加硫酸钠反应生成白色沉淀为硫酸钡,故C不选;
D.先加盐酸,在酸性条件下发生氧化还原反应生成铁离子,铁离子与二氧化硫发生氧化还原反应生成硫酸根离子,再与氯化钡反应生成硫酸钡沉淀,故D不选;
故选B.
A.发生氧化还原反应生成硫酸钡;
B.无色溶液可能含银离子或亚硫酸根离子,且二者不能同时存在;
C.先加盐酸无现象,排除银离子干扰;
D.先加盐酸,在酸性条件下发生氧化还原反应生成铁离子,铁离子与二氧化硫发生氧化还原反应生成硫酸根离子.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
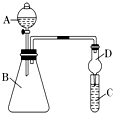
轻松课堂单元测试AB卷系列答案【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:


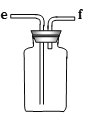
A B C D E
(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
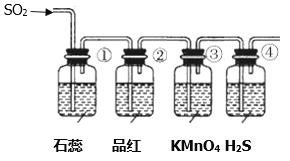
(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0g Na2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是________________________,样品中Na2SO3质量分数是_______。