题目内容
14.在水溶液中,YO3-和S2-发生反应的离子方程式如下:YO3-+3S2-+6H+═Y-+3S↓+3H2O(1)YO3-Y元素的化合价是+5.
(2)Y元素原子的最外层电子数是7.
(3)比较S2-和Y-的还原性强弱S2->Y-.
分析 (1)根据离子中化合价的代数和等于电荷数判断;
(2)根据元素的最低化合价判断其最高化合价,主族元素原子的最高正价数=其最外层电子数(O、F元素除外);
(3)根据氧化还原反应还原剂的还原性大于还原产物的还原性判断;
解答 解(1)离子中化合价的代数和等于电荷数,设Y的化合价x,所以有x+(-2)×3=-1,所以Y的化合价=+5,故答案为:+5.
(2)该反应中Y的化合价变化为:YO3-→Y-,化合价由+5价→-1价,最低负价=最高正价-8,所以其最高正价为+7价,主族元素原子的最高正价数=其最外层电子数(O、F元素除外),所以Y元素原子的最外层电子数是7,故答案为:7;
(3)该反应YO3-+3S2-+6H+═Y-+3S↓+3H2O,还原剂为S2-,还原产物为Y-,根据氧化还原反应还原剂的还原性大于还原产物的还原性,所以还原性S2->Y-,
故答案为:S2->Y-.
点评 本题考查了氧化还原反应中还原性的比较、化合价的判断及原子最外层电子数的关系,在主族元素中,元素的最高正价数=其最外层电子数,最高正价数+最低负价数的绝对值=8;

练习册系列答案
相关题目
5.以下实验或操作不能达到目的是( )
| A. | 用溴水鉴别苯、乙醇、四氯化碳 | |
| B. | 准确称取4.0 gNaOH溶于9 6 mL水得质量分数为4.0%的溶液 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| D. | 用激光笔检验淀粉溶液的丁达尔现象 |
9.乙醇、乙二醇、丙三醇分别与足量金属钠反应产生等体积的H2(相同状况下),则上述三种醇物质的量之比为( )
| A. | 2:3:6 | B. | 3:2:1 | C. | 4:3:1 | D. | 6:3:2 |
19.下列有关非金属单质的说法正确的是( )
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
| A. | ①②③⑤⑥ | B. | ②③⑥⑦ | C. | ①②③④⑦ | D. | ①②④⑥ |
6.下列实验装置或操作正确的是( )
| A. | 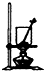 将海带灼烧成灰 | B. | 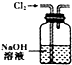 除去氯气中的HCl | C. |  实验室制取NO | D. | 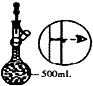 配制溶液过程 |
3.下列反应的离子方程式书写正确的是( )
| A. | Fe3O4溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | Fe3+和CO32-不能共存是因为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向NH4HCO3溶液中加入足量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
4.下列标志的高分子材料的单体,其中一种单体与其他三种单体均不是同系物的是( )
| A. |  HDPE高密度乙烯 | B. |  LDPE低密度乙烯 | C. |  DPP聚丙烯 | D. |  PS聚苯乙烯 |
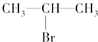 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.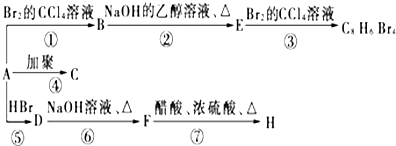

 ,D
,D ,E
,E ,F
,F .
.