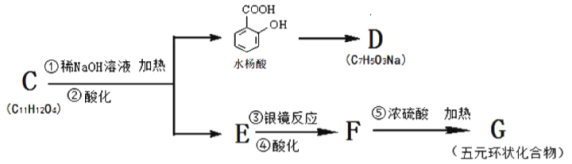
题目内容
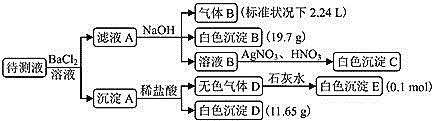
【题目】某1L待测溶液中除含有0.2mol/L的Na+外,还可能含有下列离子中的一种或多种:K+、NH4+、Fe3+、Ba2+、Cl-、Br-、CO32-、HCO3-、SO32-、SO42-。现进行如下实验操作(每次实验所加试剂均过量):
下列说法正确的是
A.待测液中一定含有NH4+、HCO3-和Cl-
B.待测液中一定没有Fe3+和Ba2+,可能含有Br-
C.生成白色沉淀B的离子方程式为:![]()
D.待测液中一定含有K+,且c(K+)=0.1mol/L
【答案】C
【解析】
加入BaCl2生成部分不溶于稀盐酸的白色沉淀,再综合给的阴离子可知待测液中含有SO42-,又因为部分白色沉淀能溶于稀盐酸并产生无色气体,可知待测液中还含有CO32-或SO32-或CO32-和SO32-,故待测液中一定含有SO42-,CO32-和SO32-至少含有一种,因为阳离子中Ba2+、Fe3+会与CO32-和SO32-反应生成沉淀,所以待测液中一定不含Ba2+、Fe3+,加入NaOH溶液后能产生气体,可知该气体为氨气,因而待测液中含有NH4+,加入BaCl2溶液不产生沉淀,滤液加入NaOH溶液后又生出白色沉淀,可知白色沉淀为BaCO3,可推知待测液中含有HCO3-,因待测液中加入BaCl2,所以溶液B中加入硝酸银产生白色沉淀不能判断待测液中是否含有氯离子,因溴化银为淡黄色沉淀,所以待测液中无Br-,白色沉淀B为BaCO3,气体B为NH3,白色沉淀E为CaCO3,白色沉淀D为BaSO4,且待测液中含有0.1molHCO3-、0.1molNH4+、0.1molCO32-、0.05molSO42-。
A.由以上分析可知,待测液中不能确定是否含有Cl-,A项错误;
B.由以上分析可知,待测液中一定没有Fe3+、Ba2+和Br-,B项错误;
C.由以上分析可知,生成白色沉淀B的离子方程式为:![]() ,C项正确;
,C项正确;
D.根据电荷守恒,溶液中一定含有K+,待测液中不能确定是否含有Cl-,假设不含Cl-,则根据溶液电中性原则可得待测液中K+最小浓度为0.1molL-1,D项错误。
答案选C。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。

(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)

①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。

(4)在容积固定的绝热容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变