题目内容
【题目】(1)实验室用浓盐酸和二氧化锰反应制取氯气时,反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O收集到7.1g氯气,求:
MnCl2+Cl2↑+2H2O收集到7.1g氯气,求:
①发生反应的二氧化锰的物质的量是多少?
②被氧化的氯化氢的物质的量是多少?
(2)把5.1g镁铝合金粉末放入500mL 1mol/L盐酸中,恰好完全反应。试计算:
①该合金中镁和铝的物质的量各为多少mol。
②将等质量的该合金投入足量的氢氧化钠溶液中,求标况下放出气体的体积。
【答案】
(1)①0.1mol;②0.2mol;
(2)①0.1 mol;0.1 mol;②3.36L
【解析】
试题分析:
(1)① MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 mol 71 g
n(MnO2) 7.1 g
n(MnO2)=![]() =0.1 mol
=0.1 mol
②被氧化的HCl的物质的量等于被氧化的Cl-的物质的量。
MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
2mol 71 g
n(Cl-) 7.1 g
n(Cl-)=![]() =0.2 mol,所以被氧化的HCl的物质的量为0.2mol。
=0.2 mol,所以被氧化的HCl的物质的量为0.2mol。
(2)① 设此合金中含![]() 的物质的量为
的物质的量为![]() ,
,![]() 的物质的量为
的物质的量为![]() ,则有
,则有![]() ①
①
500mL1mol·L-1盐酸中含![]() 的物质的量为
的物质的量为![]() ,又由下列反应的方程式得
,又由下列反应的方程式得
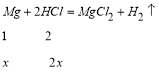
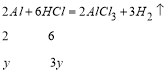
与此合金恰好反应的![]() 的量为
的量为![]() ②
②
由①②得![]()
即该合金中含有镁和铝的物质的量均为![]()
②合金中的![]() 不与
不与![]() 反应,
反应,![]() 与
与![]() 的反应方程式如下:
的反应方程式如下:

则有![]() ,解得
,解得![]() ,标准状况下其体积为
,标准状况下其体积为![]() 。
。

练习册系列答案
相关题目
【题目】下列表格中各项分类都正确的一组是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | CuSO45H2O | 液态KNO3 | 蔗糖 |
B | CaO | 海水 | 铜 | 酒精 |
C | 液氯 | 铝合金 | AgCl | CO2 |
D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
A.A
B.B
C.C
D.D