题目内容
【题目】从海水中提取蒸馏水、溴、食盐过程过如下:
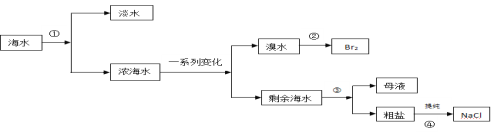
(1)从海水中获取淡水的方法实验操作是 ,需要的玻璃仪器有:酒精灯、温度计、牛角管、冷凝管、 。
(2)从溴水中获得单质溴时,采用的方法是萃取、 、蒸馏。操作是 、过滤。
下列可选作萃取剂的是
A.酒精 B.苯 C.CCl4
(3)粗盐含有Ca2+、Mg2+、SO42-等离子,为除去以上杂质离子,可加入①Na2CO3溶液②BaCl2溶液NaOH溶液④过滤⑤稀盐酸。错误的操作顺序是
A.①②③④⑤ B. ②①③④⑤ C.③②①④⑤ D. ②③①④⑤
(4)实验室用上述方法制得的NaCl配制240ml 0.1mol/LNaCl溶液。需要用托盘天平称量NaCl固体 g。配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为 。
配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】(1)蒸馏;蒸馏烧瓶、锥形瓶
(2)分液;蒸发浓缩、冷却结晶;BC (3)A
(4)1.5;②①③⑧⑤⑥⑦④;①
【解析】
试题分析:(1)从海水中获取淡水的方法实验操作是蒸馏,需要的玻璃仪器有:酒精灯、温度计、牛角管、冷凝管、蒸馏烧瓶、锥形瓶。
(2)从溴水中获得单质溴时,采用的方法是萃取、分液、蒸馏。操作是蒸发浓缩、冷却结晶、过滤。A.酒精和水互溶,不能作萃取剂,A错误;B.溴易溶在苯中,可以作萃取剂,B正确;C. 溴易溶在CCl4中,可以作萃取剂,C正确,答案选BC;
(3) Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。答案选A;
(4)实验室没有240mL容量瓶,因此需要用250mL容量瓶,则需要用托盘天平称量NaCl固体但质量是0.25L×0.1mol/L×58.5g/mol=1.5g;配制的操作顺序是计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确的操作顺序是②①③⑧⑤⑥⑦④;①定容时俯视刻度线观察液面,溶液体积减少,浓度偏高;②容量瓶使用时未干燥不影响;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,溶液体积增加,浓度偏低,答案选①。

 阅读快车系列答案
阅读快车系列答案