题目内容
18.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液.若将甲蒸发掉一半水,在乙中通入少量CO2,丙不变,然后滴加指示剂甲基橙后,用同浓度的H2SO4溶液滴定至完全反应后,所需溶液的体积大小关系为( )| A. | 甲=乙=丙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=丙>乙 |
分析 甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的硫酸,滴加指示剂甲基橙后,完全反应后溶液中的溶质均为硫酸钠,结合原子守恒计算.
解答 解:甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的硫酸,滴加指示剂甲基橙后,完全反应后溶液中的溶质均为硫酸钠,
等体积等物质的量浓度的NaOH溶液,n(NaOH)相同,
由原子守恒可知,2n(NaOH)~2n(H+)~n(H2SO4),
即消耗硫酸的物质的量相同,硫酸浓度相同,则消耗硫酸的体积相同,
故选A.
点评 本题考查离子反应的计算,侧重分析能力及计算能力的考查,把握反应后溶液中的溶质及原子守恒为解答的关键,利用守恒法可快速得到答案,简化计算过程,题目难度不大.

练习册系列答案
相关题目
8. 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )| A. | 22.40 mL | B. | 22.30 mL | C. | 23.65 mL | D. | 23.70 mL |
9.结合如图装置判断,下列叙述正确的是( )


| A. | 若X为NaCl,K与M相连时,石墨电极反应为:2Cl--2e-═Cl2↑ | |
| B. | 若X为NaCI,K与N相连时,溶液中有Fe2+生成 | |
| C. | 若X为稀硫酸,K与N相连时,溶液中H+向Fe电极移动 | |
| D. | 若X为稀硫酸,K与M相连时,Fe作负极受到保护 |
13.下列难溶盐的饱和溶液中,Ag+浓度最大的是( )
| A. | AgCl(Ksp=1.56×10-10) | B. | Ag2CO3(Ksp=8.1×10-12) | ||
| C. | Ag2CrO4(Ksp=9.0×10-12) | D. | AgBr(Ksp=5.0×10-13) |
10.关于苯乙烯(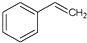 )的下列叙述,正确的是( )
)的下列叙述,正确的是( )
 )的下列叙述,正确的是( )
)的下列叙述,正确的是( )| A. | 苯乙烯不可能发生加成反应 | |
| B. | 苯乙烯不可能使酸性高锰酸钾溶液褪色 | |
| C. | 苯乙烯不可能使溴的四氯化碳溶液褪色 | |
| D. | 苯乙烯可通过加聚反应生成高分子化合物 |
7.钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH 试推断这三种物质电离出H+的难易程度(从难到易的顺序)( )
| A. | ①②③ | B. | ②③① | C. | ③①② | D. | ②①③ |
8.下列说法不正确的是( )
| A. | 进行分液操作时,应先打开上口活塞或使塞上的凹槽对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出 | |
| B. | 纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相.用该方法可分离Fe3+和Cu2+,层析后氨熏显色,滤纸上方出现红棕色斑点 | |
| C. | 酸式滴定管、碱式滴定管、容量瓶、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 | |
| D. | 在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中预先加2mL蒸馏水.以防过滤时氯化钠晶体析出 |
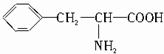 ,B的结构简式为
,B的结构简式为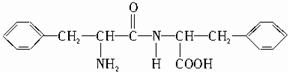 .
.