题目内容
【题目】工业上吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
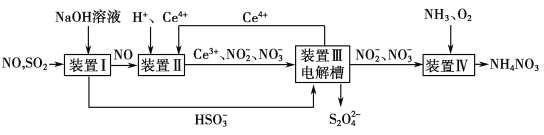
(1)Na2S2O4中S元素的化合价为________。
(2)写出装置Ⅱ中反应的离子方程式______________________________。
(3)装置Ⅲ中电解槽阴极发生的电极反应为_______________________________。
(4)从装置Ⅳ获得粗产品NH4NO3的实验操作依次为________、________、过滤、洗涤等。
【答案】(1)+3
(2)NO+3Ce4++2H2O===3Ce3++NO![]() +4H+;NO+Ce4++H2O===Ce3++NO
+4H+;NO+Ce4++H2O===Ce3++NO![]() +2H+
+2H+
(3)2HSO![]() +2H++2e-===S2O
+2H++2e-===S2O![]() +2H2O
+2H2O
(4)蒸发浓缩 冷却结晶
【解析】(1)Na2S2O4中Na显+1价,O显-2价,则S显+3价。(2)由流程图可知,装置Ⅱ中的反应物是NO、H+、Ce4+,生成物是Ce3+、NO![]() 、NO
、NO![]() ,说明Ce4+可将NO氧化成NO
,说明Ce4+可将NO氧化成NO![]() 和NO
和NO![]() ,本身被还原为Ce3+,由此可写出反应的离子方程式。(3) 由流程图可知,装置Ⅲ电解槽中Ce3+在阳极被氧化成Ce4+,HSO
,本身被还原为Ce3+,由此可写出反应的离子方程式。(3) 由流程图可知,装置Ⅲ电解槽中Ce3+在阳极被氧化成Ce4+,HSO![]() 在阴极被还原为S2O
在阴极被还原为S2O![]() ,溶液呈酸性,由此可写出阴极发生的电极反应式。(4)从NH4NO3溶液中获得NH4NO3固体的操作依次为蒸发浓缩,冷却结晶,过滤,洗涤。
,溶液呈酸性,由此可写出阴极发生的电极反应式。(4)从NH4NO3溶液中获得NH4NO3固体的操作依次为蒸发浓缩,冷却结晶,过滤,洗涤。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目