题目内容
随着环保意识的增强,清洁能源越来越受人们关注,
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:
A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1
(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4
MnFe2O4-x+
↑则框内的物质为:
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:
275.4KJ
275.4KJ
;(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:
A
A
(填序号)A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1
>
>
K2;(填“>”,“<”或“=”)(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4
| ||
| x |
| 2 |
O2
O2
;第二步反应方程式为:MnFe2O4-x+xH2O=MnFe2O4+xH2
MnFe2O4-x+xH2O=MnFe2O4+xH2
.分析:(1)根据盖斯定律来和热化学方程式的含义来计算反应的焓变;
(2)①根据浓度幂之积和平衡常数的关系来确定移动方向;
②放热反应,温度降低则平衡常数增大;
(3)根据催化剂的特点以及原子守恒知识来回答.
(2)①根据浓度幂之积和平衡常数的关系来确定移动方向;
②放热反应,温度降低则平衡常数增大;
(3)根据催化剂的特点以及原子守恒知识来回答.
解答:解:(1)CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,2H2O(g)=2H2O(l);△H=-88kJ/mol,反应CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-830kJ/mol-88kJ/mol=-918KJ/mol,16g甲烷气体燃烧生成液态水放出热量为918kJ,则4.8g甲烷气体燃烧生成液态水放出热量为918KJ×
=275.4KJ,故答案为:275.4KJ;
(2)①各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;
c(H2)=2.0mol/L,则Qc=
=
≈0.07<1,所以反应正向进行,正反应速率大于逆反应速率,故选A;
②该反应CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol为吸热反应,若将温度降至600℃时,此时平衡常数降低,所以K2<K1,故答案为:>;
(3)MnFe2O4作催化剂,则第一步反应消耗,第二步反应会生成,并且会在第二步生成氢气,根据原子守恒可以确定第一步框内的物质为氧气,故答案为:O2;MnFe2O4-x+xH2O=MnFe2O4+xH2.
| 4.8 |
| 16 |
(2)①各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;
c(H2)=2.0mol/L,则Qc=
| C(CO)?C(H2)3 |
| C(CH4)?C(H2O)2 |
| 2.0×2.03 |
| 3.0×8.52 |
②该反应CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol为吸热反应,若将温度降至600℃时,此时平衡常数降低,所以K2<K1,故答案为:>;
(3)MnFe2O4作催化剂,则第一步反应消耗,第二步反应会生成,并且会在第二步生成氢气,根据原子守恒可以确定第一步框内的物质为氧气,故答案为:O2;MnFe2O4-x+xH2O=MnFe2O4+xH2.
点评:本题考查学生热化学知识以及化学平衡移动的知识,是一道综合知识的考查,难度较大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______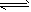 CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol 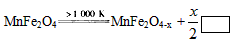 则框内的物质为:________; 第二步反应方程式为:
则框内的物质为:________; 第二步反应方程式为: H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: