题目内容
【题目】在一定温度下将3mol CO2和2mol H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K= .
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K2= , 反应 ![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g) ![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数K3= .
H2O(g)的平衡常数K3= .
(3)已知在1 000℃时,该反应的平衡常数K4为1.0,则该反应为反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正)v(逆)(填“>”、
“=”或“<”).该温度下反应达到平衡时,CO2的转化率为 .
【答案】
(1)![]()
(2)1.67;0.77
(3)吸热
(4)C
(5)>;40%
【解析】解:(1)该反应的化学平衡常数表达式K= ![]() ,所以答案是:
,所以答案是: ![]() ;(2)反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K2=
;(2)反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K2= ![]() =
= ![]() =
= ![]() =1.67;反应
=1.67;反应 ![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g) ![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数K3=
H2O(g)的平衡常数K3= ![]() =
= ![]() =0.77,
=0.77,
所以答案是:1.67;0.77;(3)在1 000℃时,该反应的平衡常数K4为1.0,升高温度平衡常数增大,平衡向正反应方向移动,说明正反应是吸热反应,所以答案是:吸热;(4)A.该反应前后气体的计量数之和不变,则无论是否达到平衡状态,容器中压强始终不变,则不能根据压强判断是否达到平衡状态,故错误;
B.c(CO2)=c(CO),该反应可能达到平衡状态,也可能没有达到平衡状态,与反应物浓度及转化率有关,所以不能判断是否达到平衡状态,故错误;
C.生成a mol CO2的同时消耗a mol H2 , 说明同一物质的正逆反应速率相等,该反应达到平衡状态,故正确;
D.混合气体的质量不变、物质的量不变,所以混合气体的平均相对分子质量始终不变,不能据此判断是否达到平衡状态,故错误;故选C;
5)
CO2(g)+ | H2(g) | ═ | CO(g)+ | H2O(g) | |
起始 | 1.5 | 1 | 0 | 0 | |
反应 | 0.5 | 0.5 | 0.5 | 0.5 | |
平衡 | 1 | 0.5 | 0.5 | 0.5 |
浓度商= ![]() =0.5<1,则反应向正反应方向移动,所以v(正)>v(逆);
=0.5<1,则反应向正反应方向移动,所以v(正)>v(逆);
3mol CO2和2mol H2混合于2L的密闭容器中,则二氧化碳和氢气的起始浓度分别为1.5mol/L、1mol/L,在1 000℃下,某时刻CO2的物质的量为2.0mol,某时刻二氧化碳的浓度是1mol/L,
设该温度下达到平衡时,反应的二氧化碳的物质的量浓度为x
CO2(g)+ | H2(g) | ═ | CO(g)+ | H2O(g) | |
起始 | 1.5 | 1 | 0 | 0 | |
反应 | x | x | x | x | |
平衡 | 1.5﹣x | 1﹣x | x | x |
![]() ,x=0.6
,x=0.6
二氧化碳的转化率= ![]() =40%,
=40%,
所以答案是:>;40%.
【考点精析】认真审题,首先需要了解化学平衡常数的含义(指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态),还要掌握化学平衡状态的判断(状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等)的相关知识才是答题的关键.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是(填序号).a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: .
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 , 混合后溶液中离子浓度由大到小的顺序是 .
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.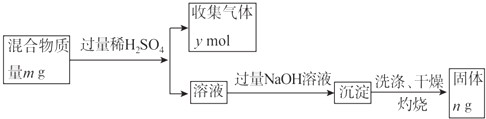
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.