��Ŀ����
ijͬѧ��������ʵ�飺
װ�� | ���� | ���� |
| ��ʢ��Ũ������ձ�A����ʢ�е���KI��Һ���ձ�C�У�Ȼ��ͭƬ�����ձ�A���������ձ�B��ס | �ձ�AҺ���Ϸ��������ִ�������ɫ���壻һ��ʱ�����ɫ������ʧ���ձ�A��C�е�Һ�嶼�����ɫ |
����˵����������
A���ձ�A�з�����Ӧ��3Cu+8HNO3===3Cu��NO3��2+2NO��+4H2O
B������ɫ������ʧֻ��NO2���ձ�C�е�KI������Ӧ�й�
C���ձ�C����Һ����ֻ��NO2��C����Һ������Ӧ�й�
D������ͭƬ������Ƭ����C�е�Һ��Ҳ���ܱ���
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д����ᣨH2C2O4����һ�ֶ�Ԫ���ᣬ�㷺�ֲ��ڶ�ֲ�����С�
��1�������ڲ����ۻ������ǵ��½�ʯ����Ҫ�ɷ��Dz���ƣ��γɵ�ԭ��֮һ�����о����֣�EDTA��һ���ܽ�Ͻ������ӵ��Լ�����һ�������¿�����Ч�ܽ��ʯ���û�ѧƽ��ԭ��������ԭ�� ��
��2����֪��0.1 mol��L��1KHC2O4��Һ�����ԡ�����˵����ȷ���� ������ĸ��ţ���
a.Ũ�Ⱦ�Ϊ0.1mol��L��1KHC2O4��K2C2O4�Ļ����Һ�У�2c(K+)=c(HC2O4-)+c(C2O42-)
b.0.1mol��L��1KHC2O4��Һ�У�c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
c.0.1mol��L��1KHC2O4��Һ�У�c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
d.0.1mol/LKHC2O4��Һ�еμӵ�Ũ��NaOH��Һ�����ԣ�c(K+)>c(Na+)
��3�����ò����Ʊ�������������(FeC2O4��xH2O)�����̼���ֲⶨ�������£�

��֪��i. pH>4ʱ��Fe2+�ױ���������
ii. �������ʵ��ܽ��(g /100g H2O)����
FeSO4��7H2O | (NH4)2SO4 | FeSO4��(NH4)2SO4��6H2O | |
20�� | 48 | 75 | 37 |
60�� | 101 | 88 | 38 |
��ϡ�������ҺpH��1��2��Ŀ���ǣ� �� ��
���ȹ��˵�ԭ���ǣ� ��
������ԭ�ζ��������ڲⶨ�������������Ħ������(M)����ȡa g����������������ϡ�����У���b mol��L��1�ĸ�����ر�Һ�ζ�������ζ��յ�ʱ�����ĸ������VmL����M = ��(��֪�����ַ�Ӧ����ΪMn2+��Fe3+��CO2)




 ��Ư�ۿ���������ɫ������Ȼʧ��ɫ����û����ף�ֻ�и���
��Ư�ۿ���������ɫ������Ȼʧ��ɫ����û����ף�ֻ�и��� ������ǣ� ��
������ǣ� �� ��Cl��
��Cl�� ��Cl����K��
��Cl����K�� ��SO
��SO
 ��Cl?��NO
��Cl?��NO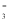 ��Na+
��Na+ ��OH?
��OH? ��Ag+��Na+��NO
��Ag+��Na+��NO