题目内容
下列溶液中各微粒浓度关系判定不正确的是
| A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1 |
| B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-) |
| C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3) |
B
试题分析:A. n(Cl-)=c·V=0.1mol/L×0.01L=0.001mol.在反应的过程中没有消耗。反应后c(Cl-)="n/L" ="0.001mol" ÷0.02L="0.05mol/L." n(NH3)= c·V=0.1mol/L×0.02L=0.002mol.反应后 n(NH3) ="n/L=0.002mol" ÷0.02L=" 0.1" mol/L根据物料守恒可得c(NH3)= c(NH4+)+c(NH3·H2O)= 0.1mol/L="2" c(Cl-).正确。B. HF、CH3COOH都是弱酸,所以NaF与CH3COOK都是强碱弱酸盐。由于酸性HF > CH3COOH,所以根据盐的水解规律:有弱才水解,越弱越水解,谁强显谁性。水解程度CH3COO->F-。n(NaF)=n(CH3COOK).水解程度越大,剩余离子的浓度就越小。所以c(K+) —c(CH3COO-) >c(Na+) —c(F-)。错误。C. 在任何溶液中都存在着电荷守恒。即阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。可得c(Na+)+c(K+)+c(H+)=c(CH3COO-)+c(OH-)+ c(NO3-)。由于NaNO3是强酸强碱盐,在溶液中不水解,所以c(Na+)=c(NO3-)。两式相减可得:c(K+)+c(H+)=c(CH3COO-)+c(OH-)。正确。D. NaHSO3是强碱弱酸的酸式盐。在溶液中存在电离平衡HSO3--
 H++ SO32--,和水解平衡:HSO3+H2O--
H++ SO32--,和水解平衡:HSO3+H2O-- OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
OH-+H2SO3。电离使溶液显酸性,水解使溶液显碱性。由于NaHSO3溶液pH<7,说明电离>水解。c(SO32-)>c(H2SO3).则根据物料守恒可得:c(Na+)= c(HSO3-) +c(SO32-)+ c(H2SO3)。由于c(HSO3-)的电离和水解消耗,所以c(Na+)> c(HSO3-)。因此在该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-) >c(H2SO3)。正确。
练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目

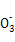 )+2c(R
)+2c(R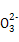 )
)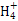 ):①<③<②
):①<③<② H++B2-
H++B2-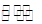 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是 S2-+H3O+
S2-+H3O+