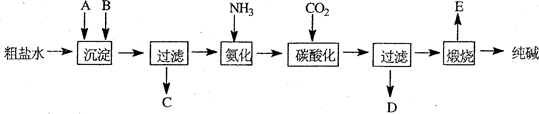
题目内容
已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出。现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mLA溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体。
②取25mLB溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体。
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式 ;
(2)为使上述①②反应完全,还需加入 ;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为 mol·L -1。
(1) H++ CO32-= HCO3- (2)稀盐酸 (3)0.5
解析试题分析:(1)少量盐酸与过量碳酸钠反应生成氯化钠和碳酸氢钠,离子方程式为H++ CO32-= HCO3-
(2)①②中A、B用量相同,若盐酸足量,则无论怎样滴加,产生的气体的体积相同,现在气体体积不同说明盐酸不足;同时①中产生的气体体积多,说明是把碳酸钠滴加到稀盐酸里,所以A为盐酸B为碳酸钠。为使反应完全,需加入稀盐酸;计算盐酸的浓度应利用①中的数据,2HCl~CO2,可计算出盐酸的浓度为0.5mol/L。
考点:考查化学中与量有关的实验现象及计算

 名校课堂系列答案
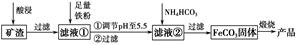
名校课堂系列答案电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤: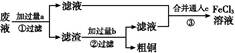
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
| |
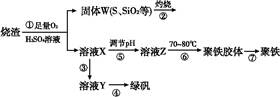
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。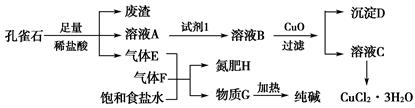
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。 

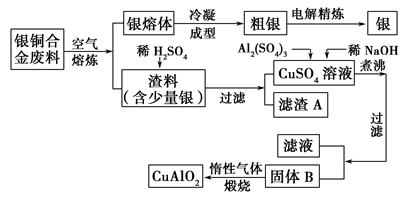
 ____CuAlO2+________↑。
____CuAlO2+________↑。