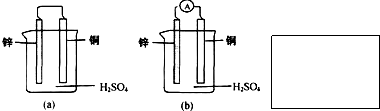
题目内容
将用导线连接的锌片和铜片插入盛有稀H2SO4的烧杯中,下列叙述正确的是( )
| A、正极有O2逸出 | B、硫酸溶液的pH增大 | C、电子通过导线由铜片流向锌片 | D、锌片上有H2逸出 |
分析:锌比铜活泼,锌为负极,被氧化,发生Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,以此解答该题.
解答:解:A.正极上发生2H++2e-═H2↑,有氢气析出,故A错误;
B.正极上发生2H++2e-═H2↑,溶液氢离子浓度降低,pH增大,故B正确;
C.电子通过导线由锌片流向铜片,故C错误;
D.锌为负极,被氧化,发生Zn-2e-═Zn2+,故D错误.
故选:B.
B.正极上发生2H++2e-═H2↑,溶液氢离子浓度降低,pH增大,故B正确;
C.电子通过导线由锌片流向铜片,故C错误;
D.锌为负极,被氧化,发生Zn-2e-═Zn2+,故D错误.
故选:B.
点评:本题综合考查原电池,侧重于学生的分析能力的考查,注意把握原电池反应原理和两极变化,明确原电池放电时电极方程式的书写是解本题的关键,难度不大.

练习册系列答案
相关题目