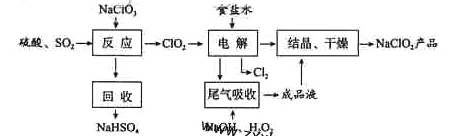
��Ŀ����
����Ŀ����ͼ��ʾ��ijʵ��С�����Ȼ�����Һ������̪����װ�á��ж������ռ���װ��ʡ��û�л��������缫����ʯī�缫��
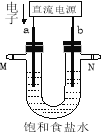
��1��a�缫������ ��
��2����������a������۲쵽������ ��
��3�������ܷ�Ӧ���ӷ���ʽΪ ��
��4��ijʵ��С����1.6A�������6.02min���������������� mL����״�������壨һ�����ӵĵ���Ϊ 1.6��10-19C����
��5������b�缫���������缫�����һ��ʱ���U�ܵײ����ֺ��ɫ���������û�ѧ����ʽ������һ����д���ܷ�Ӧ�Ļ�ѧ����ʽ ��
���𰸡���1��������
��2��a���������ݲ�������Һ��ɺ�ɫ
��3��2Cl��+2H2O ![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
��4��67.2
��5��4Fe+10H2O+O2![]() 4Fe(OH)3+4H2��
4Fe(OH)3+4H2��
��������
�����������1�����ݵ�����������a���Ǹ���������b��������������a��������b��������
�ʴ�Ϊ��������
��2������Ȼ�����Һʱ�������������ӵõ�������������2H2O+2e-=H2��+2OH-��ͬʱ���������������������ӣ����������ʼ��ԣ������̪����Һ�ʺ�ɫ��
�ʴ�Ϊ�� a������Һ��ɺ�ɫ��
��3��ͨ�����Ϸ���֪����Ӧ�����Ȼ��ƺ�ˮ���������������������������������ԣ��ܷ�Ӧ�����ӷ���ʽΪ��2Cl-+2H2O![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
�ʴ�Ϊ��2Cl-+2H2O![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
��4��������ͨ���ĵ����ΪQ=It=1.6��6.02��60C��
ͨ���ĵ�����Ϊn=![]() =
=![]() =6.02��60��1019��=6.0��10-3mol������H2O+2e-=H2��+2OH-��֪��ʱ��������3.0��10-3mol��V(H2)= n(H2)Vm=3.0��10-3mol��22.4L/mol��103mL/L=67.2mL��
=6.02��60��1019��=6.0��10-3mol������H2O+2e-=H2��+2OH-��֪��ʱ��������3.0��10-3mol��V(H2)= n(H2)Vm=3.0��10-3mol��22.4L/mol��103mL/L=67.2mL��
�ʴ�Ϊ��67.2mL��
��5������b�缫���������缫�����Һ��ΪNaCl��Һ��b�缫����ʧ���ӷ���������Ӧ���缫��ӦʽΪFe-2e-=Fe2+�����������������������ӣ��������Ӻ���������������Fe(OH)2��ɫ������Fe(OH)2���������ɺ��ɫ��Fe(OH)3���÷�Ӧ���̵��ܷ�Ӧ��ѧ����ʽΪ4Fe+10H2O+O2![]() 4Fe(OH)3+4H2����
4Fe(OH)3+4H2����
�ʴ�Ϊ��4Fe+10H2O+O2![]() 4Fe(OH)3+4H2����
4Fe(OH)3+4H2����

 ������������ϵ�д�
������������ϵ�д�