题目内容
现有0.1mol某烃与一定量O2在密闭容器中燃烧后的产物为CO2、水蒸气(烃与O2无剩余),产物经过浓硫酸后,浓硫酸质量增加10.8克,气体再通过碱石灰后被完全吸收,碱石灰质量增加22.0克.
(1)通过计算确定该烃的分子式为 ;
(2)写出该烃所有可能的结构简式 .
(1)通过计算确定该烃的分子式为
(2)写出该烃所有可能的结构简式
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)浓硫酸的质量增加10.8g为生成的水的质量,碱石灰的质量增加了22g为生成的CO2的质量,根据n=
计算水、二氧化碳的物质的量,根据原子守恒计算烃分子中C、H原子数目,进而确定烃的分子式;
(2)根据烃的分子式书写可能的结构简式.
| m |
| M |
(2)根据烃的分子式书写可能的结构简式.
解答:
解:(1)浓硫酸的质量增加10.8g为生成的水的质量,水的物质的量=
=0.6mol,
碱石灰的质量增加了22g为生成的CO2的质量,其物质的量=
=0.5mol,
故烃分子中C原子数目=
=5、H原子数目=
=12,则烃的分子式为C5H12,
故答案为:C5H12;
(2)分子式为C5H12的烃的结可能构简式有:CH3-CH2-CH2-CH2-CH3、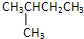 、
、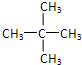 ,
,
故答案为:CH3-CH2-CH2-CH2-CH3、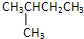 、
、 .
.
| 10.8g |
| 18g/mol |
碱石灰的质量增加了22g为生成的CO2的质量,其物质的量=
| 22g |
| 44g/mol |
故烃分子中C原子数目=
| 0.5mol |
| 0.1mol |
| 0.6mol×2 |
| 0.1mol |
故答案为:C5H12;
(2)分子式为C5H12的烃的结可能构简式有:CH3-CH2-CH2-CH2-CH3、
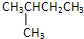 、
、 ,
,故答案为:CH3-CH2-CH2-CH2-CH3、
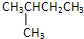 、
、 .
.
点评:本题考查利有机物分子式确定、同分异构体书写等,难度不大,掌握原子守恒判断有机物的分子式方法,掌握烷烃同分异构体的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
NA为阿伏加德罗常数,下列对0.3mol/L硫酸钾溶液的说法中,正确的是( )
| A、1L溶液中含0.3NA个K+ |
| B、1L溶液中含0.9NA个离子 |
| C、2L溶液中K+浓度是1.2mol/L |
| D、2L溶液中含0.6NA个离子 |
生活中下列处理方法正确的是( )
| A、氯气易液化,液氯可以保存在钢瓶中 |
| B、食盐可作调味剂,不能作食品防腐剂 |
| C、纺织品上的油腻用烧碱溶液清洗 |
| D、把铁器具浸入水隔绝空气防生锈 |
下列物质分类正确的是( )
| A、福尔马林、水玻璃、氨水均为混合物 |
| B、SO2、SiO2、CO均为酸性氧化物 |
| C、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| D、烧碱、冰醋酸、四氯化碳均为电解质 |

 化曲线如图所示.下列说法正确的是
化曲线如图所示.下列说法正确的是