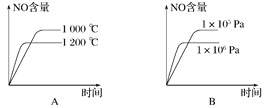
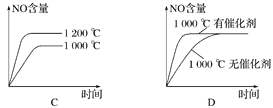
题目内容
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
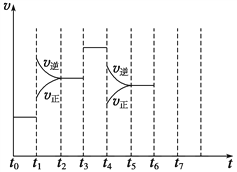
回答下列问题:
(1)t1、t3、t4时刻分别改变的一个条件是(填选项)。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻____;t3时刻____;t4时刻____。
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是_____(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_____。
【答案】 C E B A 5∶6
【解析】(1)t1时,v(正)、v(逆)同时增大,且v(逆)增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温,答案选C;t3时,v(正)、v(逆)同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂,答案选E;t4时,v(正)、v(逆)同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强,答案选B;(2)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最大,答案选A; (3)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,则反应后气体总的物质的量=(a+b-2x)mol,![]() =0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比=
=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比=![]() =
=![]() =
=![]() 。
。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法正确的是: ( )
A. 反应达到平衡时,X的转化率为60%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变浓度可以改变此反应的平衡常数