题目内容
5.下列说法正确的是( )| A. | SO2、H2O、Al均为非电解质 | |
| B. | 以碳做电极,通电后H2SO4完全电离了,并且产生了H2和O2,溶液pH降低 | |
| C. | 由非金属元素构成的物质中一定全部为共价键 | |
| D. | 同主族的元素间也可以构成离子化合物 |
分析 A.非电解质为:在水溶液和熔融状态下都不导电的化合物;
B.电离不需要通电,通电的为电解;
C.氯化铵是由非金属元素组成的离子化合物;
D.氢化钠,是由氢负离子与钠离子构成离子化合物.
解答 解:A.铝是金属单质,不属于电解质,故A错误;
B.硫酸为强电解质,在水溶液中完全电离生成氢离子与硫酸根离子,硫酸溶液以碳做电极通电发生电解,生成氢气和氧气,实质是电解质水,硫酸浓度增大,溶液pH下降,故B错误;
C.氯化铵是由非金属元素组成的离子化合物,含有离子键,故C错误;
D.氢化钠,是由氢负离子与钠离子构成离子化合物,氢与钠为同主族元素,故D正确;
故选:D.
点评 本题为综合题,考查了电解质、非电解质判断,电解与电离的区别,化学键类型判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
15.有关物质的分离,下列表述不正确的是( )
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 海水晒盐主要是依靠蒸发水使盐从溶液中析出 | |
| C. | 化学上分离出的杂质不是有害的就是没有价值的 | |
| D. | 用淘洗的方法从沙里淘金 |
16.在氯化钡溶液中通入SO2,溶液澄清,若将氯化钡溶液分盛两支试管中,一支加入氯水,另一支加烧碱溶液,然后再通入SO2,结果两试管中都有白色沉淀.由此得出下列结论合理的是( )
| A. | 氯化钡有两性 | B. | 两支试管的白色沉淀均为亚硫酸钡 | ||
| C. | SO2有还原性,是酸性氧化物 | D. | 亚硫酸的酸性比盐酸强 |
10.下列八种有机物:①CH2=CH2;②CH3CH2COOH;③C2H5OH;④CH3CH2Br;⑤CCl4;⑥CH3COOCH3;⑦CH3COOC2H5;⑧ ,根据官能团的不同可分为( )
,根据官能团的不同可分为( )
 ,根据官能团的不同可分为( )
,根据官能团的不同可分为( )| A. | 7类 | B. | 6类 | C. | 5类 | D. | 4类 |
17.下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是( )
| A. | 铝与盐酸反应 | |
| B. | 用导管向加入Na2O2粉末的棉花中吹气 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 | |
| D. | 灼热的炭与CO2反应. |
6. 溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
(1)写出制取溴苯的化学方程式 .
.
(2)仪器a的名称为三颈烧瓶,仪器c的作用是冷凝回流、导气.
(3)反应置于70-80℃水浴中而非直接加热的目的是使反应受热均匀,尽可能减少反应的挥发,防止生成的溴苯挥发.
(4)水洗后用5%氢氧化钠溶液洗涤的目的Br2+2OH-=Br-+BrO-+H2O(用离子方程式表示).
 溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.| 物质 | 溴 | 苯 | 溴苯 |
| 沸点 | 58.5℃ | 80.1℃ | 156.2℃ |
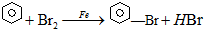 .
.(2)仪器a的名称为三颈烧瓶,仪器c的作用是冷凝回流、导气.
(3)反应置于70-80℃水浴中而非直接加热的目的是使反应受热均匀,尽可能减少反应的挥发,防止生成的溴苯挥发.
(4)水洗后用5%氢氧化钠溶液洗涤的目的Br2+2OH-=Br-+BrO-+H2O(用离子方程式表示).