题目内容
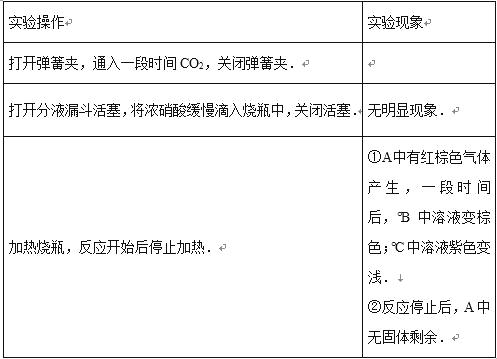
【题目】(一)为了达到下表中的实验要求,请选择合适的试剂及方法,将其标号填入对应的空格中。
实验要求 | 试剂及方法 | ||
鉴别Na2SO4溶液和NaCl溶液 | A.分别加入氯化钡溶液,观察现象 | ||
证明盐酸溶液呈酸性 | B.将气体分别通过盛有品红溶液的洗气瓶 | ||
鉴别二氧化硫和二氧化碳 | C.加入几滴碘水,观察现象 | ||
检验淘米水中是否含有淀粉 | D.在溶液滴加紫色石蕊,溶液变红 | ||
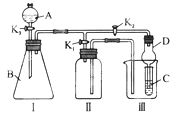
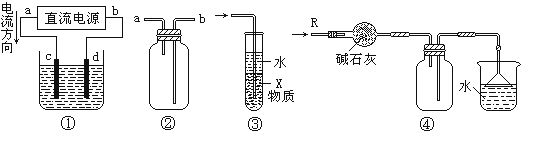
(二).甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物 .
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NOFe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
|
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 .
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 .
(3)证明A溶液中是否含有Fe3+ , 选择的药品是(填序号)( )
A.铁粉
B.溴水
C.铁氰化钾溶液
D.硫氰化钾溶液.
(4)根据实验现象写出A中一定发生反应的化学方程式
【答案】
(1)常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生
(2)取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+
(3)C
(4)铁与热的浓硝酸反应方程式Fe+6HNO3(浓) ![]() Fe(NO3)3+3NO2↑+3H2O.
Fe(NO3)3+3NO2↑+3H2O.
【解析】(一)鉴别Na2SO4溶液和NaCl溶液,分别向两种加入氯化钡溶液,观察现象,若产生白色沉淀,就证明该溶液是Na2SO4溶液,另一种是NaCl溶液。选项是A。证明盐酸溶液呈酸性,可以向该溶液中滴加紫色石蕊,溶液变红就证明溶液显酸性。选项是D。鉴别二氧化硫和二氧化碳,将气体分别通过盛有品红溶液的洗气瓶,若溶液褪色,就证明是二氧化硫,否则是二氧化碳。选项是B。检验淘米水中是否含有淀粉,加入几滴碘水,观察现象,若看到溶液变为蓝色,就证明含有淀粉。选项是C。
(二)(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生;(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+。证明A溶液中是否含有Fe3+.可以向溶液中滴加硫氰化钾溶液,若溶液变为血红色,就证明含有Fe3+ , 否则就不含Fe3+。(4)根据实验现象可知A中一定发生反应的化学方程式Fe+6HNO3(浓) ![]() Fe(NO3)3+3NO2↑+3H2O. Fe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2O.
Fe(NO3)3+3NO2↑+3H2O. Fe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2O.

【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2﹣3次后,向其中注入0.1000molL﹣1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.00 |
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是 .
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL.![]()
请计算待测烧碱溶液的浓度:mol/L.