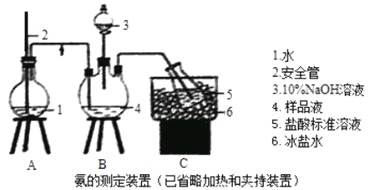
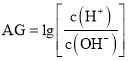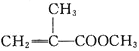题目内容
【题目】三氯硅烷(SiHCl3)在空气中极易燃烧,易与水反应生成两种酸,主要用于生产多晶硅、硅油等,熔点为-134℃、沸点为31.8℃。已知氯化氢气体在加热条件下可与单质硅反应得到三氯硅烷,某同学利用如图装置制备一定量的三氯硅烷(加热装置均省略)。
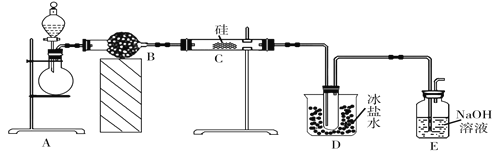
(1)制备HCl气体的方法之一是将浓硫酸与浓盐酸混合,下列性质与制备原理无关的是______(填字母),B装置的作用是_________________,冰盐水的作用是_________________
A.浓硫酸具有脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气体的溶解度随温度升高而降低
(2)实验开始后,首先要通入一段时间的HCl气体后才能对C处试剂加热,目的是:①排出装置中空气,防止硅与氧气反应,② _____________________。该套实验装置有两处明显的错误:①E中会产生倒吸,② ____________________。E装置的用途是_______________________。
(3)加热条件下,C中发生的是置换反应,相应的化学方程式为________________________。
(4)制得的SiHCl3中含有少量SiCl4(沸点为57.6℃),提纯SiHCl3采用的适宜方法为__________,收集SiHCl3时温度应控制在_____________。
(5)设计一个实验证明C中产生的气体是H2:_______________________________。
【答案】![]() 除去HCl气体中的水蒸气 冷却生成的SiHCl3,使其液化,以便收集 防止生成的SiHCl3与氧气反应 D、E之间缺少一个盛有浓硫酸的干燥装置 吸收HCl气体,防止其污染空气 Si+3HCl
除去HCl气体中的水蒸气 冷却生成的SiHCl3,使其液化,以便收集 防止生成的SiHCl3与氧气反应 D、E之间缺少一个盛有浓硫酸的干燥装置 吸收HCl气体,防止其污染空气 Si+3HCl![]() SiHCl3+H2; 蒸馏 31.8℃ 点燃E装置出口处的气体,气体能燃烧产生淡蓝色火焰,将冷而干燥的烧杯罩在火焰上方,烧杯壁上有水珠
SiHCl3+H2; 蒸馏 31.8℃ 点燃E装置出口处的气体,气体能燃烧产生淡蓝色火焰,将冷而干燥的烧杯罩在火焰上方,烧杯壁上有水珠
【解析】
(1)实验室将浓盐酸与浓硫酸混合制备HCl气体是利用难挥发性酸制备易挥发性酸,且浓硫酸具有吸水性,吸水放热,据此分析判断;B装置为干燥管,可除去水蒸气;冰盐水可降低环境温度,使SiHCl3液化;
(2)实验开始后,要先通入一段时间的HCl气体后才能对C处试剂加热,可排出装置中空气,防止硅与氧气反应,还可防止生成的SiHCl3与氧气反应;装置中的错误为:E中会产生倒吸,D、E之间缺少一个盛有浓硫酸的干燥装置;E为尾气吸收装置,可吸收没有反应掉的HCl;
(3)加热条件下,C中Si与HCl反应生成SiHCl3和H2;
(4)SiHCl3的沸点为31.8℃,SiCl4的沸点为57.6℃,根据沸点的不同进行分离并收集SiHCl3;
(5)根据氢气燃烧时的实验现象验证H2的存在。
(1)实验室将浓盐酸与浓硫酸混合制备HCl气体是利用难挥发性酸制备易挥发性酸,且浓硫酸具有吸水性,吸水放热,因此与制备原理无关的是A;B装置为干燥管,可除去HCl气体中的水蒸气;冰盐水可降低环境温度,使SiHCl3液化冷却生成的SiHCl3,使其液化,以便收集;
(2)实验开始后,要先通入一段时间的HCl气体后才能对C处试剂加热,可排出装置中的空气,防止硅与空气中的氧气发生反应,还可防止生成的SiHCl3与氧气发生反应;装置中E中会产生倒吸,D、E之间缺少一个盛有浓硫酸的干燥装置;E为尾气吸收装置,可吸收没有反应掉的HCl,f防止污染空气;
(3)加热条件下,C中Si与HCl反应生成SiHCl3和H2,反应方程式为:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
(4)SiHCl3的沸点为31.8℃,SiCl4的沸点为57.6℃,二者的沸点有差异,可用蒸馏的方法进行分离;SiHCl3的沸点为31.8℃,因此收集SiHCl3时温度应控制在31.8℃;
(5)氢气燃烧时,发出淡蓝色火焰,得到的产物为水,因此了利用氢气燃烧时的实验现象验证H2的存在,具体步骤为:点燃E装置出口处的气体,气体能燃烧产生淡蓝色火焰,将冷而干燥的烧杯罩在火焰上方,烧杯壁上有水珠。

 综合自测系列答案
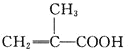
综合自测系列答案【题目】甲基丙烯酸甲酯的结构简式为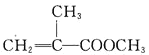 ,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
,是有机玻璃的单体,其一种实验室制备方法如下:实验装置如图1所示(夹持装置及微波加热装置已略去):
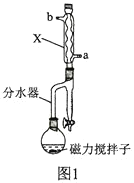
实验步骤如下:
Ⅰ![]() 量取86ml甲基丙烯酸
量取86ml甲基丙烯酸![]()
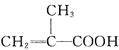
![]() 置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
置于烧杯中,在搅拌的同时加入5ml浓硫酸,冷却至室温,再加入50ml甲醇,搅拌,混合均匀;
Ⅱ![]() 将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
将混合溶液注入图1装置的反应器中,加入磁力搅拌子,微波加热温度为105℃,持续加热,充分反应;
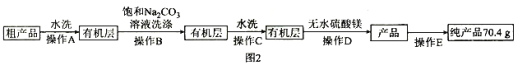
Ⅲ![]() 纯化产品,流程如图2所示:
纯化产品,流程如图2所示:
已知:
|
|
| |
溶解性 | 可溶于有机物、水 | 可溶于热水、酯 | 难溶于水、可溶于有机物 |
密度/gcm-3 | 0.79 | 1.01 | 0.94 |
沸点/℃ | 64.7 | 161 | 100~101 |
相对分子质量 | 32 | 86 | 100 |
回答下列问题:
(1)制备甲基丙烯酸甲酯的化学方程式为______________________________。
(2)图1中仪器X的名称为________________,其进水口应为________________(填“a”或“b”)口。
(3)采用微波加热可准确控制反应温度和时间,若反应温度控制不好,可能有副产物产生,写出一种有机副产物的结构简式:_________。
(4)从分水器中及时分离出水的目的是_____________________,如果分水器中的水层不再增厚,则表明__________________________。
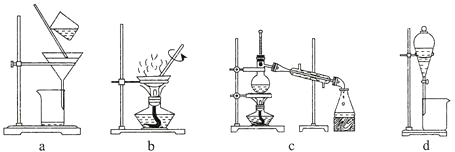
(5)纯化过程中,用“饱和碳酸钠溶液洗涤”的目的是_______________________________;完成操作C应选____________(填选项字母,下同)装置,完成操作D应选____________装置。
(6)本实验中甲基丙烯酸甲酯的产率为_________________![]() 保留三位有效数字
保留三位有效数字![]() 。
。