题目内容
(10分)原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)1mol Y2X2含有σ键的数目为 。
(2)X和Z形成的化合物为M,Y和X形成的化合物为N,则M、N中其VSEPR模型和分子立体构型相同的是 (写化学式)。
(3)W原子价电子排布式为 ,向其硫酸盐(WSO4)溶液中逐滴加入氨水至过量,发生的现象是 ,反应后的溶液中W形成的配离子的化学式为 。
(1)1mol Y2X2含有σ键的数目为 。
(2)X和Z形成的化合物为M,Y和X形成的化合物为N,则M、N中其VSEPR模型和分子立体构型相同的是 (写化学式)。
(3)W原子价电子排布式为 ,向其硫酸盐(WSO4)溶液中逐滴加入氨水至过量,发生的现象是 ,反应后的溶液中W形成的配离子的化学式为 。
⑴ 3NA(或1.806×1023) ⑵ CH4
⑶ 3d104s1 出现蓝色沉淀,后又溶解形成深蓝色溶液 〔Cu(NH3)4〕2+
⑶ 3d104s1 出现蓝色沉淀,后又溶解形成深蓝色溶液 〔Cu(NH3)4〕2+
X是原子半径最小的元素,是氢元素。最外层电子数是其内层电子数的2倍,则该元素只能是C元素,即Y是碳。Z原子基态时2p原子轨道上有3个未成对的电子,Z是氮元素。原子序数为29是铜元素。
(1) Y2X2是乙炔,其电子式为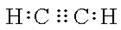 ,因为碳碳三键是由1个σ键和2π键个构成的,所以1mol Y2X2含有σ键的数目 3NA。
,因为碳碳三键是由1个σ键和2π键个构成的,所以1mol Y2X2含有σ键的数目 3NA。
(2)依据题意M、N分别是氨气和甲烷,其VSEPR模型均为四面体,但氨气中的中心原子上含有1对孤对电子,所以其实际构型是三角锥形。甲烷的VSEPR模型和分子立体构型相同均是正四面体型。
(3)对于主族元素最外层电子就是价电子,而对于副族或第Ⅷ其次外层或倒数第三层也可以是价电子,所以铜原子价电子排布式为3d104s1。铜离子易结合OH-离子形成氢氧化铜沉淀,但当氨水过量是沉淀又可以溶解,形成络合物。
(1) Y2X2是乙炔,其电子式为
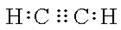 ,因为碳碳三键是由1个σ键和2π键个构成的,所以1mol Y2X2含有σ键的数目 3NA。
,因为碳碳三键是由1个σ键和2π键个构成的,所以1mol Y2X2含有σ键的数目 3NA。(2)依据题意M、N分别是氨气和甲烷,其VSEPR模型均为四面体,但氨气中的中心原子上含有1对孤对电子,所以其实际构型是三角锥形。甲烷的VSEPR模型和分子立体构型相同均是正四面体型。
(3)对于主族元素最外层电子就是价电子,而对于副族或第Ⅷ其次外层或倒数第三层也可以是价电子,所以铜原子价电子排布式为3d104s1。铜离子易结合OH-离子形成氢氧化铜沉淀,但当氨水过量是沉淀又可以溶解,形成络合物。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目