题目内容
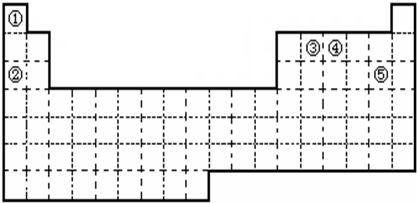
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素中化学性质最不活泼的是
(2)在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是
(3)元素 ④与⑦的最高价氧化物对应水化物反应离子方程式为
(4)⑥元素的氢化物是
(5)⑦元素与①元素形成的化合物的电子式为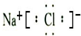
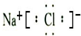 .
.
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | 2 | ⑤ | ⑥ | 3 | ① | ③ | ④ | ⑦ | ⑨ | 4 | ② | ⑧ |
(1)这九种元素中化学性质最不活泼的是
⑨
⑨
.(填元素符号,下同)(2)在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是
KOH
KOH
(填化学式).(3)元素 ④与⑦的最高价氧化物对应水化物反应离子方程式为
Al(OH)3+3H+=2Al3++3H2O
Al(OH)3+3H+=2Al3++3H2O
.(4)⑥元素的氢化物是
H2O
H2O
(填化学式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
.(5)⑦元素与①元素形成的化合物的电子式为
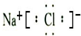
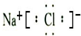
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是Na、K、Mg、Al、C、O、Cl、Br、Ar元素,
(1)稀有气体最外层电子达到稳定结构,所以其化学性质最不活泼;
(2)同一周期元素中,元素的金属性随着原子序数的增大而减弱,同一主族元素中,元素的金属性随着原子序数的增大而增强,元素的金属性越强,其最高价氧化物的水化物的碱性越强;
(3)④是铝元素,⑦是Cl元素,④的最高价氧化物的水化物是氢氧化铝,⑦的最高价氧化物的水化物是HClO4,高氯酸是最强的无机酸,氢氧化铝和高氯酸反应生成高氯酸铝和水;
(4)⑥是O元素,其氢化物是水,②是K元素,水和钾反应生成氢氧化钾和氢气;
(5)①是Na元素,⑦是Cl元素,二者形成的化合物氯化钠是离子化合物,钠离子和氯离子之间存在离子键.
(1)稀有气体最外层电子达到稳定结构,所以其化学性质最不活泼;
(2)同一周期元素中,元素的金属性随着原子序数的增大而减弱,同一主族元素中,元素的金属性随着原子序数的增大而增强,元素的金属性越强,其最高价氧化物的水化物的碱性越强;
(3)④是铝元素,⑦是Cl元素,④的最高价氧化物的水化物是氢氧化铝,⑦的最高价氧化物的水化物是HClO4,高氯酸是最强的无机酸,氢氧化铝和高氯酸反应生成高氯酸铝和水;
(4)⑥是O元素,其氢化物是水,②是K元素,水和钾反应生成氢氧化钾和氢气;
(5)①是Na元素,⑦是Cl元素,二者形成的化合物氯化钠是离子化合物,钠离子和氯离子之间存在离子键.
解答:解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是Na、K、Mg、Al、C、O、Cl、Br、Ar元素,
(1)稀有气体最外层电子达到稳定结构,所以其化学性质最不活泼,则这几种元素中,化学性质最不活泼的元素是Ar,故选⑨;
(2)同一周期元素中,元素的金属性随着原子序数的增大而减弱,同一主族元素中,元素的金属性随着原子序数的增大而增强,元素的金属性越强,其最高价氧化物的水化物的碱性越强,所以这几种元素中金属性最强的是K元素,其最高价氧化物的水化物是KOH,故答案为:KOH;
(3)④是铝元素,⑦是Cl元素,④的最高价氧化物的水化物是氢氧化铝,⑦的最高价氧化物的水化物是HClO4,高氯酸是最强的无机酸,氢氧化铝和高氯酸反应生成高氯酸铝和水,离子反应方程式为:Al(OH)3+3H+=2Al3++3H2O,
故答案为:Al(OH)3+3H+=2Al3++3H2O;
(4)⑥是O元素,其氢化物是水,②是K元素,水和钾反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:H2O;2K+2H2O=2KOH+H2↑;
(5)①是Na元素,⑦是Cl元素,二者形成的化合物氯化钠是离子化合物,钠离子和氯离子之间存在离子键,氯化钠的电子式为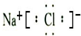 ,故答案为:
,故答案为: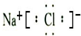 .
.
(1)稀有气体最外层电子达到稳定结构,所以其化学性质最不活泼,则这几种元素中,化学性质最不活泼的元素是Ar,故选⑨;
(2)同一周期元素中,元素的金属性随着原子序数的增大而减弱,同一主族元素中,元素的金属性随着原子序数的增大而增强,元素的金属性越强,其最高价氧化物的水化物的碱性越强,所以这几种元素中金属性最强的是K元素,其最高价氧化物的水化物是KOH,故答案为:KOH;
(3)④是铝元素,⑦是Cl元素,④的最高价氧化物的水化物是氢氧化铝,⑦的最高价氧化物的水化物是HClO4,高氯酸是最强的无机酸,氢氧化铝和高氯酸反应生成高氯酸铝和水,离子反应方程式为:Al(OH)3+3H+=2Al3++3H2O,
故答案为:Al(OH)3+3H+=2Al3++3H2O;
(4)⑥是O元素,其氢化物是水,②是K元素,水和钾反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:H2O;2K+2H2O=2KOH+H2↑;
(5)①是Na元素,⑦是Cl元素,二者形成的化合物氯化钠是离子化合物,钠离子和氯离子之间存在离子键,氯化钠的电子式为
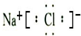 ,故答案为:
,故答案为: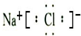 .
.点评:本题考查了元素周期表和元素周期律的综合应用,明确物质的性质是解本题关键,结合元素周期律来分析解答,注意高氯酸是最强的无机酸,为强电解质.

练习册系列答案
相关题目


 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.

