题目内容
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:
(2)为了证明溴乙烷中含有溴元素,下列操作的正确顺序是
①滴加AgNO3溶液 ②充分振荡、静置 ③取上层水溶液 ④加入5%的NaOH溶液⑤滴加过量稀HNO3.滴加AgNO3溶液时发生反应的离子方程式是
(3)菱铁矿的主要成分为FeCO3.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液.写出这一变化过程的离子方程式
SO2+H2O H2SO3、2H2SO3+O2═2H2SO4
H2SO3、2H2SO3+O2═2H2SO4
 H2SO3、2H2SO3+O2═2H2SO4
H2SO3、2H2SO3+O2═2H2SO4SO2+H2O H2SO3、2H2SO3+O2═2H2SO4
H2SO3、2H2SO3+O2═2H2SO4
. H2SO3、2H2SO3+O2═2H2SO4
H2SO3、2H2SO3+O2═2H2SO4(2)为了证明溴乙烷中含有溴元素,下列操作的正确顺序是
④②③⑤①
④②③⑤①
(填序号).①滴加AgNO3溶液 ②充分振荡、静置 ③取上层水溶液 ④加入5%的NaOH溶液⑤滴加过量稀HNO3.滴加AgNO3溶液时发生反应的离子方程式是
Ag++Br-=AgBr↓
Ag++Br-=AgBr↓
.(3)菱铁矿的主要成分为FeCO3.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液.写出这一变化过程的离子方程式
Fe2++2HCO3-=FeCO3+CO2↑+H2O
Fe2++2HCO3-=FeCO3+CO2↑+H2O
.分析:(1)二氧化硫与水反应生成亚硫酸,亚硫酸被氧化为硫酸;
(2)证明溴乙烷中含有溴元素,应先发生水解产生溴离子,再利用酸中和,最后加硝酸酸化的硝酸银;
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液,则反应物为FeSO4、NH4HCO3,生成物为FeCO3、CO2、H2O,以此来解答.
(2)证明溴乙烷中含有溴元素,应先发生水解产生溴离子,再利用酸中和,最后加硝酸酸化的硝酸银;
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液,则反应物为FeSO4、NH4HCO3,生成物为FeCO3、CO2、H2O,以此来解答.
解答:解:(1)硫酸型酸雨的形成中发生SO2+H2O H2SO3、2H2SO3+O2═2H2SO4,
H2SO3、2H2SO3+O2═2H2SO4,
故答案为:SO2+H2O H2SO3、2H2SO3+O2═2H2SO4;
H2SO3、2H2SO3+O2═2H2SO4;
(2)证明溴乙烷中含有溴元素,应先发生水解产生溴离子,再利用酸中和,最后加硝酸酸化的硝酸银,则正确的顺序是④②③⑤①,
滴加AgNO3溶液发生的离子方程式为Ag++Br-=AgBr↓,故答案为:④②③⑤①;Ag++Br-=AgBr↓;
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液,则反应物为FeSO4、NH4HCO3,
生成物为FeCO3、CO2、H2O,该反应的离子方程式为Fe2++2HCO3-=FeCO3+CO2↑+H2O,
故答案为:Fe2++2HCO3-=FeCO3+CO2↑+H2O.
 H2SO3、2H2SO3+O2═2H2SO4,
H2SO3、2H2SO3+O2═2H2SO4,故答案为:SO2+H2O
 H2SO3、2H2SO3+O2═2H2SO4;
H2SO3、2H2SO3+O2═2H2SO4;(2)证明溴乙烷中含有溴元素,应先发生水解产生溴离子,再利用酸中和,最后加硝酸酸化的硝酸银,则正确的顺序是④②③⑤①,
滴加AgNO3溶液发生的离子方程式为Ag++Br-=AgBr↓,故答案为:④②③⑤①;Ag++Br-=AgBr↓;
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液,则反应物为FeSO4、NH4HCO3,
生成物为FeCO3、CO2、H2O,该反应的离子方程式为Fe2++2HCO3-=FeCO3+CO2↑+H2O,
故答案为:Fe2++2HCO3-=FeCO3+CO2↑+H2O.
点评:本题考查化学反应方程式的书写,明确反应物与生成物是解答本题的关键,并注意化学反应方程式遵循质量守恒定律,注意(2)中不能在碱性条件下检验溴离子,题目难度不大.

练习册系列答案
相关题目
(10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):


(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
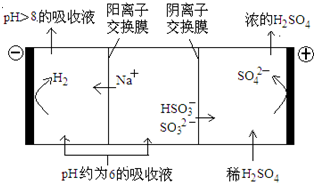 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.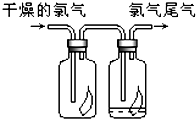 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是