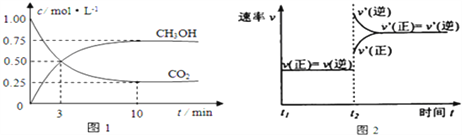
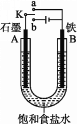
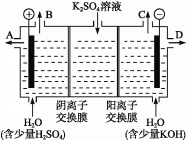
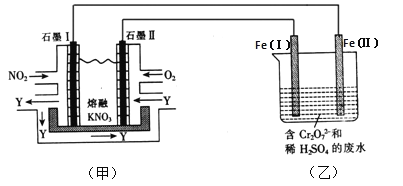
题目内容
【题目】25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,该溶液中一定能大量存在的离子是
A. CO32- B. HCO3- C. Ba2+ D. NH4+
【答案】C
【解析】25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,可知水的电离受到抑制,该溶液呈强酸性或碱性;CO32-在酸性溶液中生成二氧化碳和水,不能存在,故A错误;HCO3-既能与酸反应生成二氧化碳和水,又能与碱反应生成碳酸根离子,故B错误;Ba2+与H+、OH-都不能反应,Ba2+能大量存在,故C正确;NH4+与OH-能反应生成氨水,故D错误。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目