题目内容
【题目】利用电化学原理,将NO2、O2 和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示; 电解过程中溶液发生反应:Cr2O72-+ 6Fe2++ 14H+ = 2Cr3++ 6Fe3+ + 7H2O
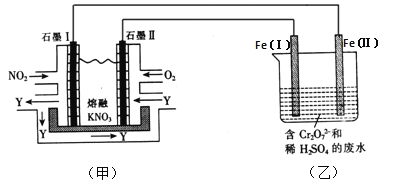
(1)甲池工作时,NO2转变成绿色硝化剂Y,Y 是N2O5,可循环使用。则石墨II 是电池的____极;石墨Ⅰ附近发生的电极反应式为________________。
(2)工作时,甲池内的NO3-离子向__________极移动(填“石墨I”或“石墨II”); 在相同条件下,消耗的 O2和NO2的体积比为________________。
(3)乙池中Fe( I)棒上发生的电极反应为___________________。
(4)若溶液中减少了0.01mol Cr2O72-,则电路中至少转移了___________________mol 电子。
(5)向完全还原为Cr3+的乙池工 业废水中滴加NaOH 溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3 存在以下 溶解平衡:Cr(OH)3(s) = Cr3+(aq) + 3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c(OH-)=1.0 ×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH 应调至_____。比色卡对照即可。
【答案】 正 NO2+NO3--e-=N2O5 石墨Ⅰ 1:4 Fe-2e-=Fe2+ 0.12 5
【解析】试题分析:(1)石墨II电极通入氧气,氧气发生还原反应;石墨Ⅰ电极NO2被氧化为N2O5;(2)电池工作时,阴离子移向负极;电池总反应为![]() ,根据总反应分析消耗的 O2和NO2的体积比。(3)乙池中Fe(I)棒与电池正极相连,Fe(I)棒是电解池阳极;(4)根据 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,溶液中减少了0.01molCr2O72-,Fe(I)棒需要生成0.06mol Fe2+;(5)根据Ksp Cr(OH)3计算c(Cr3+)降至10-5mol/L时,c(OH-),再根据
,根据总反应分析消耗的 O2和NO2的体积比。(3)乙池中Fe(I)棒与电池正极相连,Fe(I)棒是电解池阳极;(4)根据 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,溶液中减少了0.01molCr2O72-,Fe(I)棒需要生成0.06mol Fe2+;(5)根据Ksp Cr(OH)3计算c(Cr3+)降至10-5mol/L时,c(OH-),再根据![]() 计算c(H+);
计算c(H+);
解析:石墨II电极通入氧气,氧气发生还原反应,所以石墨II是电池的正极极;石墨Ⅰ电极NO2被氧化为N2O5,电极反应式为NO2+NO3--e-=N2O5;(2)电池工作时,阴离子移向负极,所以甲池内的NO3-离子向石墨I极移动;电池总反应为![]() ,所以消耗的 O2和NO2的体积比1:4。(3)乙池中Fe(I)棒与电池正极相连,Fe(I)棒是电解池阳极,所以Fe(I)棒失电子发生氧化反应,Fe-2e-=Fe2+;(4)根据 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr元素化合价由+6降低为+3;溶液中减少了0.01molCr2O72-,Fe(I)棒需要生成0.06mol Fe2+,所以电路中至少转移了0.12mol电子;(5) c(Cr3+)降至10-5mol/L时,c(OH-)=
,所以消耗的 O2和NO2的体积比1:4。(3)乙池中Fe(I)棒与电池正极相连,Fe(I)棒是电解池阳极,所以Fe(I)棒失电子发生氧化反应,Fe-2e-=Fe2+;(4)根据 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr元素化合价由+6降低为+3;溶液中减少了0.01molCr2O72-,Fe(I)棒需要生成0.06mol Fe2+,所以电路中至少转移了0.12mol电子;(5) c(Cr3+)降至10-5mol/L时,c(OH-)=![]() , c(H+)=
, c(H+)=![]() ,所以PH=5;
,所以PH=5;

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】已知: ![]() 溶液是检验
溶液是检验![]() 的试剂,若溶液中存在
的试剂,若溶液中存在![]() ,将产生蓝色沉淀。将
,将产生蓝色沉淀。将![]() 的KI溶液和
的KI溶液和![]()
![]() 溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“
溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“![]() ”的是
”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入 | 有黄色沉淀生成 |
③ | 滴入 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ① B. ②和④ C. ③和④ D. ①和②