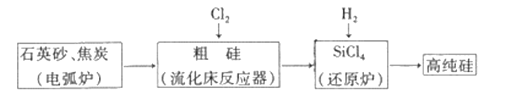
题目内容
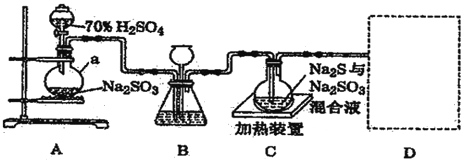
【题目】工业上常利用含硫废水生产Na2S2O3,原理是 S+Na2SO3![]() Na2S2O3 (Na2S2O3 稍过量,且该 反应的速率较慢;在酸性条件下,Na2S2O3 会自身发生氧化还原反应生成 SO2)。实验室可用如图装置(略 去部分夹持仪器)模拟生产过程。
Na2S2O3 (Na2S2O3 稍过量,且该 反应的速率较慢;在酸性条件下,Na2S2O3 会自身发生氧化还原反应生成 SO2)。实验室可用如图装置(略 去部分夹持仪器)模拟生产过程。
(1)Na2S2O3 中硫元素的化合价_______________。
(2)仪器 a 的名称______________,装置A中产生气体的化学方程式为_________________________ 。
(3)装置 B 的作用除观察 SO2 的生成速率外,长颈漏斗的作用是 ______________________________ 。
(4)装置 C 中需控制在碱性环境,否则产品发黄(生成黄色物质),用离子方程式表示其原因_________。
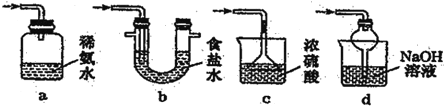
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___________(填字母)。
【答案】+2价 圆底烧瓶 Na2SO3+H2SO4═Na2SO4+SO2↑+H2O 缓冲装置(或者平衡装置内外压强等) S2O32-+2H+═S↓+SO2↑+H2O; d
【解析】
(1)化合物中化合价代数和等于0。
(2)仪器a为圆底烧瓶,生成气体二氧化硫的反应为浓硫酸和亚硫酸钠反应;
(3)装置 B观察SO2的生成速率,二氧化硫通过溶液不能与SO2反应,有气泡逸出,长颈漏斗的作用是平衡装置内外压强;
(4)酸性溶液中硫代硫酸根离子会反应生成单质硫;
(5)用于处理尾气,吸收未反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中。
(1)化合物中化合价代数和等于0,Na2S2O3 中硫元素的化合价:+2价。
(2)仪器a为圆底烧瓶,生成气体二氧化硫的反应为浓硫酸和亚硫酸钠反应
故答案为:圆底烧瓶;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,溶液不能与SO2反应,用饱和NaHSO3溶液,与二氧化硫不反应,除观察SO2生成速率的作用外,装置中长颈漏斗的作用起到缓冲装置(或者平衡装置内外压强等),
故答案为:缓冲装置(或者平衡装置内外压强等);
(4)酸性溶液中硫代硫酸根离子会反应生成单质硫,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O;
(5)a.装置应将导管伸入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d。

 阅读快车系列答案
阅读快车系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.2 | 0.1 | 0.1 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.2 |
A. 反应可表示为3X+Y![]() 2Z
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则平衡向右移动