题目内容
【题目】在某有机物A的分子中,具有酚羟基、醇羟基、羧基等官能团,其结构简式如图.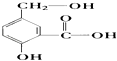
请同学们根据官能团
①A跟NaOH溶液反应的化学方程式是:
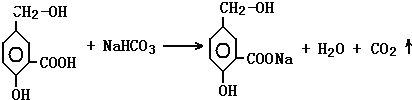
②A跟NaHCO3溶液反应的化学方程式是:
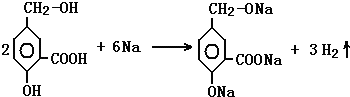
③A在一定条件下跟Na反应的化学方程式是: .
【答案】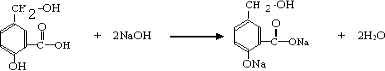 ;
; ;
;
【解析】解:①酚﹣OH、﹣COOH均与NaOH溶液反应,该反应为 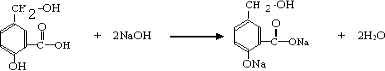 ,
,
所以答案是: 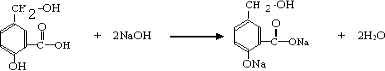 ;
;
②A中含有羧基,可与碳酸氢钠发生反应,反应的方程式为 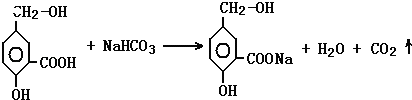 ,
,
所以答案是:  ;
;
③A中含有酚羟基、醇羟基和羧基,都可与钠反应生成氢气,反应的方程式为  ,
,
所以答案是: 
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.

【题目】有三份白色固体分别为碳酸钠、碳酸氢钠及二者的混合物。某化学课外活动小组对其进行相关实验和探究。
I.甲组同学采用加热的方法确定其成分。
(1)除托盘天平、药匙、三脚架、泥三角、玻璃棒和干燥器外,完成本实验还需要的实验仪器有_________。
(2)该小组同学准确称取一定量的样品m1g,多次加热、冷却、称量直至恒重,质量为m2g。依据得出结论,请完成下表。
m2与m1的关系 | 结论 | |
① | 样品为Na2CO3 | |
② | 样品为NaHCO3 | |
③ | 样品为Na2CO3和 NaHCO3的混合物 |
II.乙组同学利用已鉴别出的NaHCO3和Na2CO3,继续进行实验,对于“能否用CaCl2鉴别的NaHCO3和Na2CO3”的问题进行探究。
(3)小组同学先将NaHCO3、Na2CO3、CaCl2固体分别配制成0.5mol/L的溶液。设汁如下实验方案:
表1
实验方案 | 预测现象 | |
实验1 | 向2mL Na2CO3溶液中滴加1mL CaCl2溶液 | 有白色沉淀生成 |
实验2 | 向2mL NaHCO3溶液中滴加1mL CaCl2溶液 | 无白色沉淀生成 |
若已知:①室温下,0.5mol/L NaHCO3溶液pH=8.5,溶液中c(HCO3-)=0.49 mol/L 。
②室温下, H2CO3的二级电离常数K2=5.6×10-11。
③Ksp(CaCO3)=2.8×10-9。
试估算使0.5mol/L NaHCO3溶液中的CO32-沉淀所需的c(Ca2+)应不低于_____mol/L,并由此得出结论:实验2的预测现象_____(填“正确”或“不正确”)。
⑷实际实验过程发现实验2的现象为白色沉淀并有无色气体生成。此现象对应的离子方程式为_____________。
(5)该小组同学继续设计实验对NaHCO3溶液与CaCl2溶液的反应进行探究,利用气体压力传感器得到的部分实验数据如下:(注:CaCl2溶液浓度相同)
表2 容器内气体浓度达到10000ppm所需时间
C(NaHCO3)/(mol/L) | 所需时间/s | |||
v(CaCl2):v(NaHCO3) | ||||
1:5 | 2:5 | 4:5 | 1:1 | |
1.0 | 142 | 124 | 114 | 156 |
0.5 | 368 | 264 | 244 | 284 |
0.25 | 882 | 450 | 354 | 632 |
0.1 | 1126 | 1316 | 816 | 1816 |
由实验数据可得出的结论是:
①当v(CaCl2):v(NaHCO3)一定时,随着_____,气体逸出速率减小;
②NaHCO3浓度在0.1~1.0mol/L,v(CaCl2)与v(NaHCO3)的比值为____时,气体逸出速率最快,可获得理想的实验观察效果。