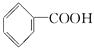
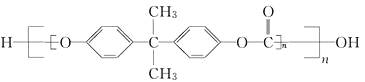
题目内容
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下: 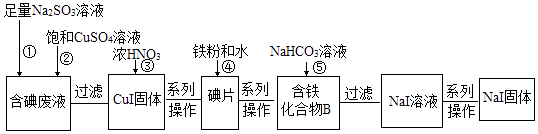
已知反应②:2I﹣+2Cu2++SO32﹣+H2O═2CuI↓+SO42﹣+2H+ .
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、 .
(2)反应③中CuI被氧化,还原产物只有NO2 , 该反应的化学方程式为 . 当有95.5g CuI参与反应,则需要标况下L的O2才能将生成的NO2在水中完全转化为硝酸.
(3)化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,则化合物B的化学式为 .
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为 .
(5)将足量的Cl2通入含12g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为g.
【答案】
(1)玻璃棒
(2)2CuI+8HNO3(浓)═2Cu(NO3)2+4NO2↑+I2+4H2O;5.6
(3)Fe3I8
(4)Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O
(5)4.68
【解析】解:(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、玻璃棒,玻璃棒用于引流,所以答案是:玻璃棒;(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为2CuI+8HNO3(浓)═2Cu(NO3)2+4NO2↑+I2+4H2O,当有95.5g CuI参与反应,即n(CuI)= ![]() =0.5mol,由方程式可知生成1molNO2,则通入氧气发生4NO2+2H2O+O2=4HNO3,消耗0.25mol氧气,体积为5.6L,
=0.5mol,由方程式可知生成1molNO2,则通入氧气发生4NO2+2H2O+O2=4HNO3,消耗0.25mol氧气,体积为5.6L,
所以答案是:2CuI+8HNO3(浓)═2Cu(NO3)2+4NO2↑+I2+4H2O;5.6;(3)化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,另一种元素为I,则化合物B的化学式为Fe3I8,所以答案是:Fe3I8;(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,应为四氧化三铁,无色气体为二氧化碳,则反应⑤的化学方程式为Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O,
所以答案是:Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O;(5)n(NaI)= ![]() =0.08mol,则与足量氯气反应生成0.08molNaCl,则m(NaCl)=0.08mol×58.5g/mol=4.68g,
=0.08mol,则与足量氯气反应生成0.08molNaCl,则m(NaCl)=0.08mol×58.5g/mol=4.68g,
所以答案是:4.68.

【题目】如表是元素周期表的一部分,用化学用语回答:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
二 | ] | ① | ② | ||||
三 | ③ | ④ | ⑤ | ⑥ | |||
四 | ⑦ |
(1)②的元素符号为 .
(2)比较元素③和⑦的原子半径大小:③⑦(填“>”或“<”).
(3)绘出元素⑤的离子结构示意图 .
(4)元素①的氢化物的电子式为 , 将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为 .