题目内容
使一定的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜,第一支玻璃管中由于发生如下反应:2PH3+3Cu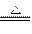 Cu3P2(s)+3H2,玻璃管质量增加4.96 g,第二支玻璃管中发生反应后质量减少了5.76 g。
Cu3P2(s)+3H2,玻璃管质量增加4.96 g,第二支玻璃管中发生反应后质量减少了5.76 g。
(1)计算原混合气体中,磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
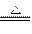 Cu3P2(s)+3H2,玻璃管质量增加4.96 g,第二支玻璃管中发生反应后质量减少了5.76 g。
Cu3P2(s)+3H2,玻璃管质量增加4.96 g,第二支玻璃管中发生反应后质量减少了5.76 g。(1)计算原混合气体中,磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
(1)4∶3 (2)0.91 g·L-1
设PH3、H2的物质的量分别为x mol、y mol。
2PH3+3Cu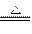 Cu3P2(s)+3H2 增重
Cu3P2(s)+3H2 增重
2 mol 3 mol 62 g
x mol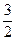 x mol 31x g
x mol 31x g
31x g="4.69" g
x=0.16
H2+CuO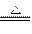 H2O+Cu 减少
H2O+Cu 减少
1 mol 16 g
(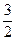 x+y) mol 16(
x+y) mol 16(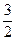 x+y) g
x+y) g
16(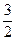 x+y) g="5.76" g
x+y) g="5.76" g
y=0.12
(1)V(PH3)∶V(H2)="0.16" mol∶0.12 mol=4∶3
(2)标准状况下,混合气体的密度为
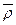 (混)=
(混)=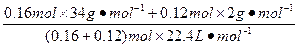 ="0.91" g·L-1。
="0.91" g·L-1。
2PH3+3Cu
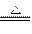 Cu3P2(s)+3H2 增重
Cu3P2(s)+3H2 增重2 mol 3 mol 62 g
x mol
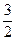 x mol 31x g
x mol 31x g31x g="4.69" g
x=0.16
H2+CuO
 H2O+Cu 减少
H2O+Cu 减少1 mol 16 g
(
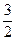 x+y) mol 16(
x+y) mol 16(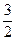 x+y) g
x+y) g16(
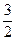 x+y) g="5.76" g
x+y) g="5.76" gy=0.12
(1)V(PH3)∶V(H2)="0.16" mol∶0.12 mol=4∶3
(2)标准状况下,混合气体的密度为
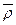 (混)=
(混)=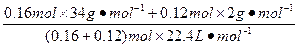 ="0.91" g·L-1。
="0.91" g·L-1。
练习册系列答案
相关题目