题目内容
(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,A的最高价氧化物的化学式
是 。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写) 。
(3)E的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物发生反应的化学方
程式是 。
(4)简述比较D与E金属性强弱的实验方法; 。
(1)第三周期第ⅡA族(1分),(不写全得0分) N2O5 (1分)
(2)O<N<Al<Mg<Na (2分)
(3)Al(OH)3+NaOH=NaAlO2+2H2O (2分)
(4)镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应。
(其他答案合理也可以给分)。
【解析】地壳中含量最高的金属元素是铝元素,即E是铝,则C、
D、E是第三周期元素,A、B是第二周期元素。A原子的最外层电子数比次外层电子层多3个,所以A是氮元素。又因为A、B、C、D、E都是短周期元素,原子序数依次增大,所以C、D只能分别是钠和镁元素。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,因此B是氧元素,甲和乙分别是氧化钠和过氧化钠。
(1)氮元素是第ⅤA,最高价是+5价,最高价氧化物的化学式为N2O5。
(2)同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以正确的顺序为O<N<Al<Mg<Na。
(3)氢氧化钠是强碱,氢氧化铝是两性氢氧化物,二者反应的方程式为
Al(OH)3+NaOH=NaAlO2+2H2O。
(4)在比较金属性强弱时一般可以借助元素周期律,也可以是与水反应的难易程度,或者与酸反应置换出氢气的难易程度,或是最高价氧化物对应水化物的碱性强弱以及相应之间的转化能力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 CH3COOH+OH-
CH3COOH+OH- 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是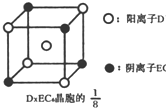
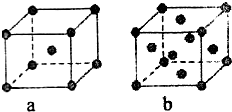 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.