题目内容
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子![]() 的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定Ag++2CN-====[Ag(CN)2]-,终点时,溶液由黄色变成橙红色。

根据以上知识回答下列问题:
(1)水样预处理的目的是________________________________________。
(2)水样预处理的装置如图,细导管插入吸收液中是为了____________________。
(3)蒸馏瓶比吸收液面要高出很多,其目的是______________________________。
(4)如果用盐酸代替磷酸进行预处理,实验结果将__________(填“偏高”“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为__________ mg·L-1(以CN-计,计算结果保留一位小数)。
(1)将含氰化合物全部转化为CN-
(2)完全吸收HCN,防止气体放出
(3)防止倒吸
(4)偏高
(5)109.2
解析:
本题以工业废水(含氰化合物)为背景,在给定预处理及测定原理后设置相关问题。解题关键是认真审题,读取有用信息。(1)根据预处理信息,其预处理目的在于将含氰化合物转化为HCN,再用NaOH吸收以形成NaCN,以便测定中用AgNO3溶液进行滴定;(2)装置图中细导管插入吸收液中,目的是为了减缓气流量,尽可能把HCN全部吸收,防止污染空气;(3)由于HCN易被碱液吸收,容易引起倒吸,图示装置没用安全瓶等,而是让左右装置高低错位,以达防倒吸的目的;(4)由于盐酸易挥发出HCl,被NaOH溶液吸收后又与AgNO3反应,从而使AgNO3耗量增加,最终导致测定结果偏高;(5)由于:Ag+~2CN-,所以氰化物含量为:(0.010 00 mol·L-1×21.00 mL×10-3 L·mL-1×2×26 g·mol-1×103 mg·g-1)÷(100 mL·10-3 L·mL-1)=109.2 mg·L-1。

 金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子M(CN)nm-的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子M(CN)nm-的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下: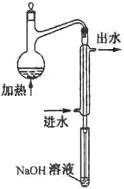 Ag++2CN - == [Ag(CN)2] -
Ag++2CN - == [Ag(CN)2] -

