题目内容
室温下,稀氨水中存在电离平衡NH3+H2O NH3.H2O
NH3.H2O NH4++OH-,有关叙述正确的是( )
NH4++OH-,有关叙述正确的是( )A.加入氯化铵固体,溶液中
 减小
减小B.加水不断稀释,溶液碱性一定增强
C.加水稀释,
 增大
增大D.加入氢氧化钠固体,能使上述平衡向左移动
【答案】分析:A、加入氯化铵,稀氨水中存在电离平衡逆向移动,氢氧根离子的浓度减小;
B、加水促进电离,但氢氧根离子的浓度减小;
C、由NH3.H2O NH4++OH-,只要温度不变,则电离平衡常数不变;
NH4++OH-,只要温度不变,则电离平衡常数不变;
D、加入氢氧化钠固体,氢氧根离子的浓度增大,电离平衡逆向移动.
解答:解:A、加入氯化铵固体,铵根离子的浓度增大,则稀氨水中存在电离平衡逆向移动,氢氧根离子的浓度减小,由水的离子积可知,氢离子的浓度增大,则溶液中 变大,故A错误;
变大,故A错误;
B、加水促进电离,氢氧根离子的物质的量增大,但溶液体积增大的更多,故氢氧根离子的浓度减小,从而碱性减弱,故B错误;
C、由NH3.H2O NH4++OH-,加水虽促进电离,但没有改变温度,则电离平衡常数不变,即
NH4++OH-,加水虽促进电离,但没有改变温度,则电离平衡常数不变,即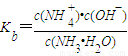 不变,故C错误;
不变,故C错误;
D、加入氢氧化钠固体,氢氧根离子的浓度增大,生成物中离子浓度变大,则电离平衡向左移动,故D正确;
故选D.
点评:本题考查弱电解质的电离平衡,明确温度、浓度等影响电离平衡的因素是解答本题的关键,并注意温度不变、电离常数不变来解答.
B、加水促进电离,但氢氧根离子的浓度减小;
C、由NH3.H2O
 NH4++OH-,只要温度不变,则电离平衡常数不变;
NH4++OH-,只要温度不变,则电离平衡常数不变;D、加入氢氧化钠固体,氢氧根离子的浓度增大,电离平衡逆向移动.
解答:解:A、加入氯化铵固体,铵根离子的浓度增大,则稀氨水中存在电离平衡逆向移动,氢氧根离子的浓度减小,由水的离子积可知,氢离子的浓度增大,则溶液中
 变大,故A错误;
变大,故A错误;B、加水促进电离,氢氧根离子的物质的量增大,但溶液体积增大的更多,故氢氧根离子的浓度减小,从而碱性减弱,故B错误;
C、由NH3.H2O
 NH4++OH-,加水虽促进电离,但没有改变温度,则电离平衡常数不变,即
NH4++OH-,加水虽促进电离,但没有改变温度,则电离平衡常数不变,即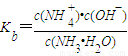 不变,故C错误;
不变,故C错误;D、加入氢氧化钠固体,氢氧根离子的浓度增大,生成物中离子浓度变大,则电离平衡向左移动,故D正确;
故选D.
点评:本题考查弱电解质的电离平衡,明确温度、浓度等影响电离平衡的因素是解答本题的关键,并注意温度不变、电离常数不变来解答.

练习册系列答案
相关题目
 M(OH)2
M(OH)2  2H++MO22-
2H++MO22- NH3.H2O
NH3.H2O NH4++OH-,有关叙述正确的是( )
NH4++OH-,有关叙述正确的是( )