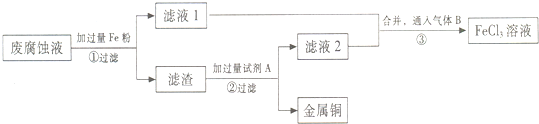
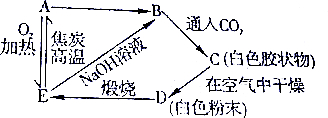
题目内容
16.a mol氢气在b mol氯气中燃烧,将所得混合气体冷却至室温,用30mL2mol•L-1 NaOH溶液恰好完全吸收,测得溶液中NaClO的物质的量为0.02mol.(1)NaOH溶液中溶质的物质的量为0.06mol.
(2)生成NaClO的反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(3)所得溶液中Cl-的物质的量为0.04mol.
(4)b:a=3:1.
分析 (1)n(NaOH)=CV;
(2)氯气和NaOH反应生成NaCl和NaClO;
(3)根据Na原子守恒计算n(Cl-);
(4)因为氯气有剩余,则氢气完全反应,根据Na、Cl原子守恒计算b;
根据Cl原子、H原子守恒计算a.
解答 解:(1)n(NaOH)=CV=2mol/L×0.03L=0.06mol,
故答案为:0.06mol;
(2)氯气和NaOH反应生成NaCl和NaClO,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)根据Na原子守恒计算n(Cl-)=n(NaCl)=n(NaOH)-n(NaClO)=0.06mol-0.02mol=0.04mol,
故答案为:0.04;
(4)因为氯气有剩余,则氢气完全反应,
根据Na原子守恒得n(NaOH)=n(NaCl)+n(NaClO)=0.06mol,根据Cl原子守恒得n(Cl2)=$\frac{1}{2}$[n(NaCl)+n(NaClO)]=$\frac{1}{2}$×0.06mol=0.03mol;
氯气生成的n(NaCl)=n(NaClO)=0.02mol,则HCl生成的n(NaCl)=0.04mol-0.02mol=0.02mol,
根据Cl原子守恒得n(HCl)=n(NaCl)(HCl生成的)=0.02mol,根据H原子守恒得n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.02mol=0.01mol,则b:a=0.03mol:0.01mol=3:1,
故答案为:3:1.
点评 本题考查氧化还原反应化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,注意原子守恒的灵活运用,题目难度中等.

练习册系列答案
相关题目
6.既有离子键又有共价键的化合物是( )
| A. | NH4NO3 | B. | NaCl | C. | H2SO4 | D. | H2O |
4.1.28g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为( )
| A. | 64g | B. | 64 | C. | 64 g/mol | D. | 32 g/mol |
11.根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c═4.18×10-3 kJ•g-1•℃-1,则该反应的中和热为△H=55.16.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0.5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏小(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成放出的能量偏小,所以测得的△H偏大,中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 常温常压下,11.2L H2所含的原子数目小于NA | |
| C. | 0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA个 |
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 由C(石墨)═C(金刚石))△H=+1.90/mol可知,金刚石比石墨稳定 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |