题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1molSiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和D2O的混合物中,所含中子数为9NA
【答案】D
【解析】A、根据SiO2的结构,1molSiO2中含有4molSi-O键,即0.1molSiO2晶体中含有0.4molSi-O键,故A错误;B、铁与水蒸气反应生成Fe3O4和H2,因此56g铁与水蒸气反应,转移电子物质的量为![]() mol=8/3mol,故B错误;C、氯气溶于水,只有少量的氯气与水反应,无法计算出转移电子物质的量,故C错误;D、假设18g全部是H218O,含有中子物质的量为18×(0+10)/20mol=9mol,假设18g全部是D2O,D为2H,含有中子物质的量为18×(2+8)/20mol=9mol,因此18g此混合物中含有中子物质的量为9mol,故D正确。
mol=8/3mol,故B错误;C、氯气溶于水,只有少量的氯气与水反应,无法计算出转移电子物质的量,故C错误;D、假设18g全部是H218O,含有中子物质的量为18×(0+10)/20mol=9mol,假设18g全部是D2O,D为2H,含有中子物质的量为18×(2+8)/20mol=9mol,因此18g此混合物中含有中子物质的量为9mol,故D正确。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
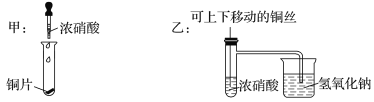
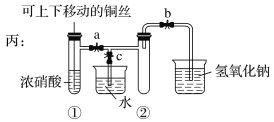
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D