题目内容
【题目】如表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)元素④的名称是 ,从元素原子得失电子的角度看,元素④具有 性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性: (写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是 (用离子符号表示)
(4)元素⑦的原子结构示意图是 ;
(5)最高价氧化物对应水化物酸性最强的酸是 ,化学性质最稳定的是 金属性最强的元素是 (用化学符号表示)
【答案】(1)氧;氧化;
(2)H2O>H2S>PH3;
(3)N3﹣>O2﹣>Na+;
(4)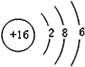 ;
;
(5)HClO4;Ne;Na.
【解析】试题分析:由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl,
(1)元素④在周期表中位置,可知其处于第二周期ⅥA族;容易获得电子;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,气态氢化物越稳定;
(3)离子的电子层数相同时,核电荷数越大,离子半径越小;
(4)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(5)高氯酸的酸性最强;上述元素中Na的金属性最强,化学性质最稳定的为稀有气体.
解:由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl,
(1)元素④处于第二周期ⅥA族,为氧元素;氧元素容易获得电子,表现氧化性,
故答案为:氧;氧化;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,故非金属性:O>S>P,非金属性越强,气态氢化物越稳定,故氢化物稳定性:H2O>H2S>PH3,
故答案为:H2O>H2S>PH3;
(3)元素③④⑤分别为N、O、Na,形成的离子分别为N3﹣、O2﹣、Na+,离子的电子层数相同,核电荷数越大,离子半径越小,则离子半径由大到小的顺序是:N3﹣>O2﹣>Na+,
故答案为:N3﹣>O2﹣>Na+;
(4)元素⑦是S元素,硫原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为: ,
,
故答案为: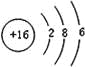 ;
;
(5)高氯酸的酸性最强,其化学式为HClO4;上述元素中化学性质最稳定的为稀有气体Ne;金属性最强的为金属Na,
故答案为:HClO4;Ne;Na.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案