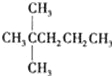
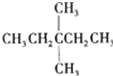
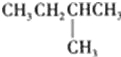题目内容
【题目】原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),
电极反应式为 .Zn极发生 (填“氧化”或“还原”)反应.溶液中H+移向 (填“Cu”或“Zn”)极.
(2)无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻 g.
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
【答案】(1)正;2H++2e﹣=H2↑;氧化;Cu;
(2)6.5;
(3)否;此反应为非氧化还原反应,且反应吸热.
【解析】
试题分析:(1)该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn﹣2e﹣=Zn2+、正极反应为2H++2e﹣=H2↑,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)根据锌和转移电子之间的关系式计算;
(3)原电池反应必须是自发进行的放热的氧化还原反应.
解:(1)该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为2H++2e﹣=H2↑,锌失电子发生氧化反应,电解质溶液中氢离子向正极Cu极移动,故答案为:正;2H++2e﹣=H2↑;氧化;Cu;
(2)根据锌和转移电子之间的关系式得,消耗锌的质量=![]() =6.5g,故答案为:6.5;
=6.5g,故答案为:6.5;
(3)原电池反应必须是自发进行的放热的氧化还原反应,该反应是吸热反应且不是氧化还原反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热.

【题目】如表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)元素④的名称是 ,从元素原子得失电子的角度看,元素④具有 性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性: (写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是 (用离子符号表示)
(4)元素⑦的原子结构示意图是 ;
(5)最高价氧化物对应水化物酸性最强的酸是 ,化学性质最稳定的是 金属性最强的元素是 (用化学符号表示)