题目内容
在2L密闭容器内,反应2NO2(g) NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化关系如下图所示。请回答下列问题:
NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化关系如下图所示。请回答下列问题:
 NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化关系如下图所示。请回答下列问题:
NO(g)+O2(g)在三种不同的条件下进行实验,其中实验I、Ⅱ都是在800℃,实验Ⅲ是在850℃;NO、O2的起始浓度都为0,NO2的起始浓度都为1.0 mol/L,NO2的浓度随时间的变化关系如下图所示。请回答下列问题: 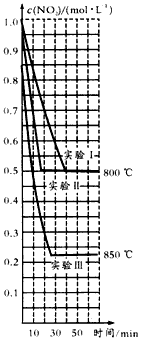
(1)①该反应的平衡常数表达式为:K=______________________。 ②下列叙述不能说明该反应已达到平衡状态的是______________。
a.v正(NO2)=2v逆(O2)
b.c(NO2) =c(NO)
c.气体的平均摩尔质量不变
d.NO的体积分数保持不变
(2)①对比实验I、Ⅱ和Ⅲ,得出的下列结论正确的是________。
a.实验Ⅱ和I相比,可能隐含的条件是:反应容器的体积缩小了
b.实验Ⅱ和I相比,可能隐含的条件是:使用了效率更高的催化剂
c.实验I的平衡常数大于实验Ⅲ的平衡常数
d.对比实验I和Ⅲ可知,该可逆反应的正反应是放热反应
②下图是实验I中NO体积分数V%随时间t的变化曲线,请在图中补画实验Ⅲ中NO体积分数V%随时间t的变化曲线。
a.v正(NO2)=2v逆(O2)
b.c(NO2) =c(NO)
c.气体的平均摩尔质量不变
d.NO的体积分数保持不变
(2)①对比实验I、Ⅱ和Ⅲ,得出的下列结论正确的是________。
a.实验Ⅱ和I相比,可能隐含的条件是:反应容器的体积缩小了
b.实验Ⅱ和I相比,可能隐含的条件是:使用了效率更高的催化剂
c.实验I的平衡常数大于实验Ⅲ的平衡常数
d.对比实验I和Ⅲ可知,该可逆反应的正反应是放热反应
②下图是实验I中NO体积分数V%随时间t的变化曲线,请在图中补画实验Ⅲ中NO体积分数V%随时间t的变化曲线。
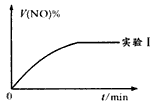
(3)实验I,从反应开始到平衡时,v(O2)=_________ mol/(L·min)。若实验I中将NO2的起始浓度改为1.2 mol/L,其他条件不变,NO2的转化率将______________(填“增大”“减少”或“不变”)。
(4)若实验I平衡后,再向该2L密闭容器中通入1molNO2与l mol NO、0.5molO2组成的混合气体,则平衡将________移动(填“向右”“向左”“不”或“无法确定”)。 再次达到平衡后,__________ mol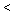 n(NO)
n(NO) 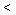 _________mol。
_________mol。
(4)若实验I平衡后,再向该2L密闭容器中通入1molNO2与l mol NO、0.5molO2组成的混合气体,则平衡将________移动(填“向右”“向左”“不”或“无法确定”)。 再次达到平衡后,__________ mol
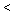 n(NO)
n(NO) 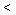 _________mol。
_________mol。(1)①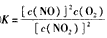 ②b
②b
(2)①b②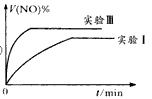
(3)6.25×10-3 mol/(L·min);减少
(4)向左;1;2
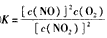 ②b
②b (2)①b②

(3)6.25×10-3 mol/(L·min);减少
(4)向左;1;2

练习册系列答案
相关题目
氮是地球上含有丰富的一种元素,氮及其化合物在公农业生产、生活中有着重
要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一。
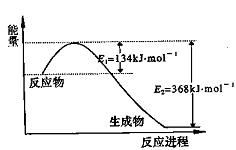
(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出
NO2和CO反应的热化学方程式: ;
又知:N2 (g)+2NO2 (g)=4NO(g) △H=+292.3kJ?mol―1,则反应:
2NO(g)+2CO(g) ![]() N2(g)+2CO2 (g)的△H为 ;
N2(g)+2CO2 (g)的△H为 ;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2 (g)+O2 (g) ![]() 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
① 写出该反应的平衡常数表达式:K= ,已知:![]() ,则该反
,则该反
应是 热反应;
② 反应达到平衡后,NO2的转化率为 ,此时若再通入一定量氮气,则NO2
的转化率将 (填“增大”、“减小”、“不变”);
③ 下图中表示N2O5的浓度的变化曲线是 ,
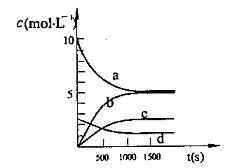
用O2表示从0~500s内该反应的平均速率v= 。
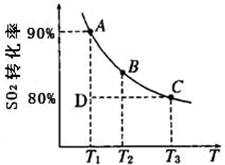 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位. (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位. 2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。 