题目内容
5.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
分析 A、求出乙烷的物质的量,然后根据乙烷中含7条共价键来分析;
B、甲醛和冰醋酸的最简式均为CH2O;
C、常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA;
D、pH=12的氨水溶液中氢氧根浓度为0.01mol/L;
D、酯化反应为可逆反应.
解答 解:A、30g乙烷的物质的量为1mol,而乙烷中含7条共价键,故1mol乙烷中含7NA条共价键,故A错误;
B、甲醛和冰醋酸的最简式均为CH2O,故2.0g混合物中含有的CH2O的物质的量为0.1mol,故含0.4NA个原子,故B正确;
C、pH=12的氨水溶液中氢氧根浓度为0.01mol/L,故1L溶液中氢氧根的物质的量为0.01mol,根据电荷守恒可知:n(OH-)=n(NH4+)+n(H+),故n(NH4+)小于0.01mol即小于0.01NA个,故C错误;
D、酯化反应为可逆反应,不能进行彻底,故生成的水分子个数小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构.

练习册系列答案
相关题目
3.在室温下,同种规格的镁条分别与下列物质混合,产生H2速率最快的是( )
| A. | 0.2mol/L的硫酸10mL | B. | 0.25mol/L的盐酸20mL | ||
| C. | 18.4mol/L的硫酸30mL | D. | 0.3mol/L的硝酸20mL |
13.下列属于物理变化的是( )
| A. | 煤的干馏 | B. | 石油分馏 | C. | 煤的气化 | D. | 氨溶于水 |
20.国际顶尖的纳米材料学家,美国艺术与科学院院士杨培东教授通过人工光合作用合成燃料,其主要方法是CO2+H2O+阳光$\stackrel{催化剂}{→}$燃料+O2,以下不能当作燃料的是( )
| A. | C3H6 | B. | C6H12O6 | C. | C2H2 | D. | CCl4 |
10.用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的是( )
| A. |  如图验证溴乙烷发生消去反应生成烯烃 | |
| B. | 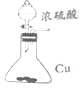 如图进行浓硫酸与铜的反应 | |
| C. |  如图实验验证酸性:CH3COOH>H2CO3>C6H5OH | |
| D. |  如图吸收氨气 |
17.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 室温下,pH=12的NaAlO2溶液中,由水电离得OH-数目为0.01NA | |
| B. | 常温常压下,N2H4和CH3OH的混合物64g含有12NA个原子 | |
| C. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| D. | 苯与液溴反应生成1mol溴苯,消耗0.5NA个Br2 |
14.将1mol CH4和适量的O2在密闭容器中点燃,充分反应后CH4和O2均无剩余,产物的总质量为72g,且均为气体(101kPa,120℃),下列有关叙述不正确的是( )
| A. | 反应中消耗O2 56 g | |
| B. | 所得产物中各物质的物质的量相等 | |
| C. | 若将产物通过碱石灰,不能被完全吸收 | |
| D. | 若将产物通过浓硫酸,充分吸收后,浓硫酸增重36g |
15.下列生活中常见物质的用途与其还原性有关的是( )
| A. |  碘酒中的碘 | B. |  暖宝宝中的铁粉 | ||
| C. |  抗酸药中的氢氧化铝 | D. |  尿不湿中的聚丙烯酸钠 |