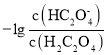题目内容
【题目】![]() 时,在某物质的溶液中,由水电离出的
时,在某物质的溶液中,由水电离出的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 时,水的电离受到抑制
时,水的电离受到抑制
B.![]() 时,水的电离受到抑制
时,水的电离受到抑制
C.![]() 时,溶液的pH一定为a
时,溶液的pH一定为a
D.![]() 时,溶液的pH一定为
时,溶液的pH一定为![]()
【答案】B
【解析】
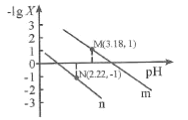
酸或碱抑制水电离,含有弱酸阴离子或弱碱阳离子的盐促进水电离,由水电离出的![]() ,如果
,如果![]() ,说明水的电离程度减小,水的电离受抑制,溶质可能是酸或碱;如果
,说明水的电离程度减小,水的电离受抑制,溶质可能是酸或碱;如果![]() ,说明水的电离程度增大,促进水电离,溶质可能是含有弱酸阴离子或弱碱阳离子的盐。
,说明水的电离程度增大,促进水电离,溶质可能是含有弱酸阴离子或弱碱阳离子的盐。
酸或碱抑制水电离,含有弱酸阴离子或弱碱阳离子的盐促进水电离,由水电离出的![]() ,如果
,如果![]() ,说明水的电离程度减小,水的电离受抑制,溶质可能是酸或碱;如果
,说明水的电离程度减小,水的电离受抑制,溶质可能是酸或碱;如果![]() ,说明水的电离程度增大,促进水电离,溶质可能是含有弱酸阴离子或弱碱阳离子的盐,该溶液的pH可能为a或
,说明水的电离程度增大,促进水电离,溶质可能是含有弱酸阴离子或弱碱阳离子的盐,该溶液的pH可能为a或![]() ,
,
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
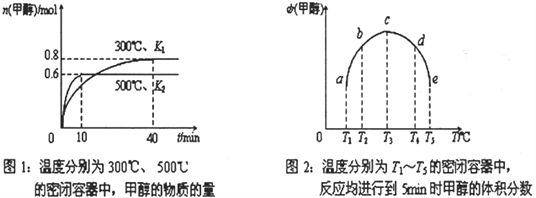
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
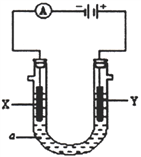
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
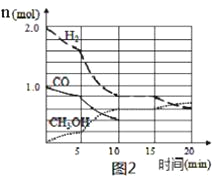
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。
【题目】某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___。
(2)简述银氨溶液的配制过程:___。
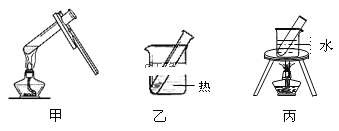
(3)步骤D应选择的加热方法是___(填下列装置编号),理由是___。
(4)乙醛发生银镜反应的化学方程式___。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的是___。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]![]() 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+![]() Ag
Ag![]() +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___。
②加入的铁粉要过量的目的是___。
③该实验过程中可能产生的大气污染物是___。