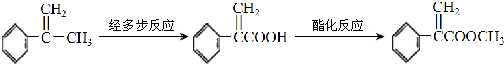题目内容
17. 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.(1)NO2可用水吸收,相应的化学反应方程式为3NO2+H2O=2HNO3+NO.利用反应6NO2+8NH3$?_{△}^{催化剂}$7N2+12H2O也可处理NO2.当转移0.4mol电子时,消耗的NO2在标准状况下的体积是2.24L.
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为2OH-+SO2=SO32-+H2O;若继续通入SO2,当n (SO2):n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是a (填字母编号).
a.c(Na+)>c(HSO3 -)>c(SO32-)
b.c(Na+)+c(H+)=c(SO32-)+c(HSO3 -)+c(OH-)
c.c(Na+)=c(SO32-)+c(HSO3 -)
SO2也可用O2氧化生成SO3
已知:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ/mol;
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ/mol;
则反应2SO2(g)+O2(g)?2SO3(g)△H=-196 kJ/mol.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示.
①该反应△H<0(填“>”或“<”).
②若容器容积不变,下列措施可提高CO转化率的是b.
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大
d.再充入一定量的 CO气体.
分析 (1)二氧化氮溶于水生成硝酸和一氧化氮,根据化合价的变化结合方程式计算;
(2)二氧化硫为酸性氧化物,溶于碱生成盐;亚硫酸氢钠溶液中存在水的电离、亚硫酸氢根离子的电离和水解平衡;c(SO32-)>c(H2SO3),说明HSO3-的电离程度大于水解程度;依据盖斯定律计算反应热;
(3)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动,据此解答即可.
解答 解:(1)二氧化氮溶于水生成硝酸和一氧化氮,化学反应方程式为:3NO2+H2O=2HNO3+NO,反应6NO2+8NH3$?_{△}^{催化剂}$7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移0.4mol电子时,消耗NO20.1mol,体积为2.24L,故答案为:3NO2+H2O=2HNO3+NO;2.24
(2)二氧化硫为酸性氧化物,溶于足量氢氧化钠生成亚硫酸钠,离子反应方程式为:2OH-+SO2=SO32-+H2O,
当n (SO2):n(NaOH)=1:1时,发生反应:OH-+SO2=HSO3-,亚硫酸氢钠溶液中存在水的电离、亚硫酸氢根离子的电离和水解平衡,方程式为:H2O?H++OH-、HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-,由于溶液呈酸性,故HSO3-的电离程度大于水解程度,则c(HSO3 -)>c(SO32-),故a正确;
任何溶液中均存在电中性原则:故:c(Na+)+c(H+)=2c(SO32-)+c(HSO3 -)+c(OH-),故b错误;
由物料守恒得出:c(Na+)=c(SO32-)+c(HSO3 -)+c(H2SO3),故c错误;
NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ/mol;①
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ/mol;②
①×2+②得:2SO2(g)+O2(g)?2SO3(g),故△H=-41.8kJ/mol×2+(-113.0kJ/mol)=-196.6kJ/mol,
故答案为:2OH-+SO2=SO32-+H2O;a;-196.6;
(3)①从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动,故此反应为放热反应,故答案为:<;
②a.此反应为放热反应,升高温度,平衡左移,不利于CO转化,故a错误;
b.将CH3OH(g)从体系中分离,导致甲醇浓度降低,平衡右移,提高了CO的转化率,故b正确;
c.容器容积不变,充入氦气,对反应无影响,故c错误;
d.再充入一定量的 CO气体,可以增加氢气的转化率,CO本身转化率减小,故d错误,
故选b.
点评 本题主要考查的是化学反应方程式书写、离子反应方程式书写、平衡移动原理应用、盖斯定律的有关计算等,综合性较强,有一定难度.

 名校课堂系列答案
名校课堂系列答案| A. | 碱在水中的溶解度 | B. | 乙酸溶液的pH | ||
| C. | 合成氨的反应热 | D. | 醋酸钠溶液中的氢氧根离子浓度 |
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=106的溶液中:NH4+、K+、AlO2-、NO3- | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- |
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
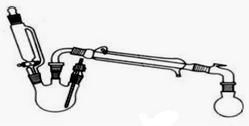
已知:当乙酸乙酯安装物质的量1:1投料时,乙酸的转化率为65%,当乙酸和乙醇按照物质的量1:10投料时,乙酸的转化率为97%(数据均在120℃下测定).
实验过程:
Ⅰ.合成反应:在三颈烧瓶中加入乙醇5mL,浓硫酸5mL,2小片碎瓷片.漏斗加入乙酸14.3 mL,乙醇20 mL.冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120℃.
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾.最终通过蒸馏得到纯净的乙酸乙酯.
回答下列问题:
(1)酯化反应的机理探究
A、乙醇羟基氧示踪
CH2CO
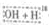 OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2OB、用醋酸烃基氧示踪

实验B发现,产物中含氧-18水占到总水量的一半,酯也一样.这个实验推翻了酯化反应为简单的取代反应的结论.请你设想酯化反应的机理先加成反应生成
 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成 .
.(2)酯化反应是一个可逆的反应,120℃时,平衡常数K=3.45.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验用到的量取液体体积的仪器是量筒,浓硫酸与乙醇混合应怎样操作?先加入乙醇后加入硫酸,边振荡加滴加.
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(6)蒸出的粗乙酸乙酯中主要有哪些杂质乙醚、乙酸、乙醇和水.用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 除去苯中混有的少量苯酚,加入适量NaOH溶液,振荡、静置后分液 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,有沉淀产生,加水,沉淀重新溶解 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵是离子化合物 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |

 ;反应③
;反应③ .
.