题目内容
设NA表示阿伏加德罗常数,下列说法正确的是
- A.将5.6克铁投入一定量的硝酸中,转移电子数为0.3NA
- B.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
- C.1.72g生石膏(CaSO4?2H2O) 转化为熟石膏(2CaSO4?H2O) 失去的结晶水数目为0.015NA
- D.1 mol冰中,氢键的数目是NA
C
分析:A、铁与硝酸反应可以生成硝酸铁或硝酸亚铁或二者混合物,铁也可能不能完全反应.
B、硝酸钠是强电解质,完全电离,NaNO3溶液中含有钠离子、硝酸根离子、氢离子、氢氧根离子、水分子.
C、根据n= 计算生石膏的物质的量,生石膏中结晶水的物质的量为生石膏的2倍;根据钙元素守恒可知熟石膏的物质的量为生石膏的
计算生石膏的物质的量,生石膏中结晶水的物质的量为生石膏的2倍;根据钙元素守恒可知熟石膏的物质的量为生石膏的 ,熟石膏中结晶水的物质的量等于熟石膏的物质的量.据此计算判断.
,熟石膏中结晶水的物质的量等于熟石膏的物质的量.据此计算判断.
D、冰中1个水分子周围有4个水分子通过氢键连接.根据均摊法计算.
解答:A、将5.6克铁的物质的量为0.1mol,若铁完全反应生成硝酸铁,转移电子数为0.3NA,若铁完全反应生成硝酸亚铁,转移电子数为0.2NA,若铁完全反应生成硝酸铁或硝酸亚铁或二者混合物,转移电子数大于0.2NA,小于0.3NA,若铁有剩余,转移的电子数小于0.2NA,故A错误;
B、硝酸钠是强电解质,完全电离,溶液中不存在硝酸钠,0.5L0.5mol/L的NaNO3溶液中钠离子与硝酸根的物质的量之和为0.5mol,二者数目为0.5×6.02×1023,NaNO3溶液中含有钠离子、硝酸根离子、氢离子、氢氧根离子、水分子.溶液中粒子数目远远大于0.5×6.02×1023,故B错误;
C、1.72g生石膏(CaSO4?2H2O)的物质的量为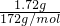 =0.01mol,含有结晶水的物质的量为0.02mol,根据钙元素守恒可知熟石膏(2CaSO4?H2O)的物质的量为0.005mol,含有的结晶水为0.005mol,所以失去的结晶水数目为(0.02mol-0.005mol)×NAmol-1=0.015NA,故C正确;
=0.01mol,含有结晶水的物质的量为0.02mol,根据钙元素守恒可知熟石膏(2CaSO4?H2O)的物质的量为0.005mol,含有的结晶水为0.005mol,所以失去的结晶水数目为(0.02mol-0.005mol)×NAmol-1=0.015NA,故C正确;
D、冰中1个水分子周围有4个水分子通过氢键连接,每个水分子相当于含有2个氢键,所以1mol冰中,氢键的数目是2NA,故D错误.
故选:C.
点评:考查常用化学计量计算、过量计算、晶体结构、电解质溶液粒子等,难度中等,注意A可能发生的反应情况与D中冰的晶体结构.
分析:A、铁与硝酸反应可以生成硝酸铁或硝酸亚铁或二者混合物,铁也可能不能完全反应.
B、硝酸钠是强电解质,完全电离,NaNO3溶液中含有钠离子、硝酸根离子、氢离子、氢氧根离子、水分子.
C、根据n=
 计算生石膏的物质的量,生石膏中结晶水的物质的量为生石膏的2倍;根据钙元素守恒可知熟石膏的物质的量为生石膏的
计算生石膏的物质的量,生石膏中结晶水的物质的量为生石膏的2倍;根据钙元素守恒可知熟石膏的物质的量为生石膏的 ,熟石膏中结晶水的物质的量等于熟石膏的物质的量.据此计算判断.
,熟石膏中结晶水的物质的量等于熟石膏的物质的量.据此计算判断.D、冰中1个水分子周围有4个水分子通过氢键连接.根据均摊法计算.
解答:A、将5.6克铁的物质的量为0.1mol,若铁完全反应生成硝酸铁,转移电子数为0.3NA,若铁完全反应生成硝酸亚铁,转移电子数为0.2NA,若铁完全反应生成硝酸铁或硝酸亚铁或二者混合物,转移电子数大于0.2NA,小于0.3NA,若铁有剩余,转移的电子数小于0.2NA,故A错误;
B、硝酸钠是强电解质,完全电离,溶液中不存在硝酸钠,0.5L0.5mol/L的NaNO3溶液中钠离子与硝酸根的物质的量之和为0.5mol,二者数目为0.5×6.02×1023,NaNO3溶液中含有钠离子、硝酸根离子、氢离子、氢氧根离子、水分子.溶液中粒子数目远远大于0.5×6.02×1023,故B错误;
C、1.72g生石膏(CaSO4?2H2O)的物质的量为
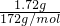 =0.01mol,含有结晶水的物质的量为0.02mol,根据钙元素守恒可知熟石膏(2CaSO4?H2O)的物质的量为0.005mol,含有的结晶水为0.005mol,所以失去的结晶水数目为(0.02mol-0.005mol)×NAmol-1=0.015NA,故C正确;
=0.01mol,含有结晶水的物质的量为0.02mol,根据钙元素守恒可知熟石膏(2CaSO4?H2O)的物质的量为0.005mol,含有的结晶水为0.005mol,所以失去的结晶水数目为(0.02mol-0.005mol)×NAmol-1=0.015NA,故C正确;D、冰中1个水分子周围有4个水分子通过氢键连接,每个水分子相当于含有2个氢键,所以1mol冰中,氢键的数目是2NA,故D错误.
故选:C.
点评:考查常用化学计量计算、过量计算、晶体结构、电解质溶液粒子等,难度中等,注意A可能发生的反应情况与D中冰的晶体结构.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目