题目内容
【题目】氮化锂是一种紫色或红色的晶状固体,易水解,可用作贮氢材料。在空气中长期暴露,最终会变成碳酸锂。实验室用干燥、纯净的N2与金属锂(密度为0.534 g·cm-3)反应制取氮化锂。某实验小组拟选择下列装置完成该实验(有些装置可不用,也可重复使用)。
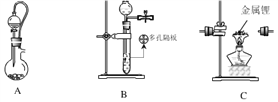

已知:锂与氨会反应生成LiNH2和H2。
回答下列问题:
(1)实验室保存金属锂的方法是__________________。
(2)若用生石灰与浓氨水混合制备少量氨气,选择上述装置制备少量氮化锂,则按气流从左至右的方向,装置的连接顺序为_________________(用字母表示)。
(3)装置E的作用是_____________,装置D中发生反应的化学方程式为______________________。
(4)上述实验的实验步骤如下:
①装药品; ②引发反应产生氨气;③检査装置气密性;④点燃装置C处酒精灯;⑤点燃装置D处酒精灯。正确的操作顺序为_________________________(填序号)。
(5)氮化锂易水解生成氢氧化锂和氨气,该反应的化学方程式为____________________。
(6)设计简单实验证明装置C中的产物为氮化锂:____________________。
【答案】 封存在石蜡中 A、F、D、E、C、F 吸收氨气并干燥氮气 3CuO+2NH3![]() 3Cu+N2+3H2O ③①②⑤④ Li3N+3H2O=3LiOH+NH3↑ 取少量产物于试管中,滴入少量蒸馏水,用镊子夹取湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则说明产物为氮化锂
3Cu+N2+3H2O ③①②⑤④ Li3N+3H2O=3LiOH+NH3↑ 取少量产物于试管中,滴入少量蒸馏水,用镊子夹取湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则说明产物为氮化锂
【解析】(1)锂是活泼金属,密度小于煤油,应封存在石蜡中;(2)B 装置适用“难溶块状固体与液体反应”,应选 A 装置制备氨气。制备氨气、干燥氨气、氨气与氧化铜反应、除氨气并干燥氮气、氮气与锂反应、防止空气中水蒸气进入装置。连接过程中装置可以重复使用,故正确的连接顺序为 A、F、D、E、C、F;(3)E 装置有两个作用:吸收未反应完全的氨气并干燥氮气。根据实验目的和氧化还原反应原理知,氧化铜在加热条件下与氨气反应生成铜、氮气和水,其反应的化学方程式为:3CuO+2NH3![]() 3Cu+N2+3H2O;(4)实验步骤:检查装置气密性、装药品、制氨气、通入氨气排空气、加热氧化铜制氮气、 氮气排尽装置内空气、加热锂,故正确的操作顺序为③①②⑤④;(5)氮化锂中氮为-3 价,锂为+1 价,化学式为Li3N,与水反应生成氢氧化锂和氨气,其反应的化学方程式为:Li3N+3H2O=3LiOH+NH3↑;(6)利用氮化锂与水反应产生 NH3,通过检验 NH3 来确认是否有氮化锂生成。设计简单实验为:取少量产物于试管中,滴入少量蒸馏水,用镊子夹取湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则说明产物为氮化锂。
3Cu+N2+3H2O;(4)实验步骤:检查装置气密性、装药品、制氨气、通入氨气排空气、加热氧化铜制氮气、 氮气排尽装置内空气、加热锂,故正确的操作顺序为③①②⑤④;(5)氮化锂中氮为-3 价,锂为+1 价,化学式为Li3N,与水反应生成氢氧化锂和氨气,其反应的化学方程式为:Li3N+3H2O=3LiOH+NH3↑;(6)利用氮化锂与水反应产生 NH3,通过检验 NH3 来确认是否有氮化锂生成。设计简单实验为:取少量产物于试管中,滴入少量蒸馏水,用镊子夹取湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则说明产物为氮化锂。

 快捷英语周周练系列答案
快捷英语周周练系列答案