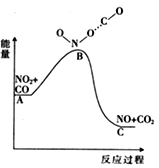
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 0.1 mol丙烯酸中含有的双键数目为0.1NA
B. 常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3NA
C. 标准状况下,2.24 L Cl2溶于足量的水中充分反应后,溶液中Cl-数为0.2NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3NA
【答案】D
【解析】
A. 1mol丙烯酸中含2mol双键;
B.二氧化氮、四氧化二氮摩尔质量不同;
C.氯气与水反应生成HCl和HClO,且为可逆反应;
D.过氧化钠阳离子为钠离子,阴离子为过氧根离子。
A.丙烯酸中含碳碳双键和碳氧双键,故1mol丙烯酸中含2mol双键,即0.1mol丙烯酸中含有双键的数目为0.2NA,故A错误;
B.二氧化氮、四氧化二氮摩尔质量不同,只知道混合物总质量无法计算混合气体物质的量,无法计算分子个数,故B错误;
C.标准状况下,2.24LCl2物质的量为![]() =0.1mol,与足量水反应,溶液中Cl-数小于0.2NA,故C错误;
=0.1mol,与足量水反应,溶液中Cl-数小于0.2NA,故C错误;
D、Na2S和Na2O2摩尔质量相同,过氧化钠是由钠离子和过氧根离子构成,7.8g Na2S和Na2O2的混合物物质的量为0.1mol,含有的离子总数为0.3NA,所以D选项是正确的。
故答案选D。

【题目】由下列实验操作及现象能得出相应结论的是
操作 | 现象 | 结论 | |
A. | 将蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液一定为浓盐酸 |
B. | 向 CH3COONa 溶液中滴入酚酞试液,加热 | 加热后红色加深 | CH3COONa 水解是吸热反应 |
C. | 向某溶液中加入盐酸,将产生 的气体通入澄清石灰水 | 澄清石灰水变浑浊 | 该溶液中一定有 CO32— |
D. | 向 NaCl 溶液中滴加过量 AgNO3 溶液,再滴加 KI 溶液 | 先出现白色沉淀, 后出现黄色沉淀 | Ksp(AgI) < Ksp(AgCl) |
A. A B. B C. C D. D